Die Geschichte begann vor ca. 20 Jahren, bereits damals faszinierten mich Präparate von Holzschnitten, aber da mich andere mikroskopische Themen mehr fesselten, verfolgte ich das Thema nicht weiter. Zwischen vielen anderen Präparaten befanden sich aber auch immer wieder Hölzer. Vor nunmehr zweieinhalb Jahren hat mich Klaus Hermann, mittlerweile leider verstorben, gefragt, ob wir uns bei einem Holzanatomie Seminar von Bernd Miggel im Schwarzwald treffen wollten. Das Seminar war ein echtes Highlight und für mich der Anstoß mir ein Typ „C“ Hartmetallmesser bei Leitz Biosystems zu leisten. Diese Anschaffung bedeutete einen echten Wendepunkt hinsichtlich Qualität und Komfort bei der Herstellung von Holzschnitten.
Rund um das Sommertreffen (2021) der Mikroskopischen Gesellschaft in Schloss Weinberg (Kefermarkt/OÖ) hatten Unwetter ziemliche Schäden im Baumbestand angerichtet, ideale Voraussetzungen, um Stammholzproben zu sammeln. Danach wurden die Proben auf einem Jung HN-40 Mikrotom mit Hartmetallmesser geschnitten und die Präparate fertiggestellt.
Die Erfahrungen aus diesem Sommertreffen und zahlreiche weitere haben Sylvia Buchta und mich zu diesem zweiteiligen Artikel über Holzschnitte motiviert. Die Präparate zeigen jedoch nicht nur Holz, sondern können auch von anderen stark verholzenden Pflanzen (z. B. Wilder Wein) stammen.
Der erste Teil beschäftigt sich mit dem „making of“ und der zweite Teil stellt einige unterschiedliche Pflanzen, in den für Holz klassischen Schnittrichtungen Q (quer), T (tangential) und R (radial) gegenüber. Da gibt es z. B. Unterschiede in der Anatomie, die auf den ersten Blick eine grobe Zuordnung (z. B. Nadel- oder Laubholz) zulassen. In diesem Teil werden zwar die Ergebnisse in den drei Schnittlagen eines Laubholzes gegenüberstellen, aber der Schwerpunkt liegt im „making of“. Dabei werden wir die Arbeitsschritte von der Probenaufbereitung für den Schnitt bis zum Eindecken abhandeln und mit Bildern einige der Arbeitsschritte visualisieren.
Danksagung
Es gibt unzählige Mikroskopiker und Mikroskopikerinnen, denen ich meine Erfahrung – Erfahrung ist die Summe aller Fehlschläge – und die zur Bewältigung benötigten Tipps und Tricks verdanke. Stellvertretend für alle sei Bernd Miggel erwähnt, der mich – und später damit auch Sylvia Buchta auf den „Holzweg“ brachte.




Wenn es die Fragestellung zulässt, ist es zweckmäßig, wenn man das Probenmaterial kennt oder bestimmt, denn es ist nicht bedeutungslos, was man schneidet. Klassische Bestimmungsliteratur oder Apps (z. B. Plantnet) können vor Ort als Unterstützung herangezogen werden. Das Probenmaterial (Abb. 1) kann ganzjährig gesammelt werden. Wenn man nicht im eigenen Garten fündig wird, sind Forstarbeiten eine gute Möglichkeit an Proben zu gelangen, z. B. Schnittkeile. Es ist darauf zu achten, dass frisches Holz verwendet wird, da sonst eine Verpilzung die Strukturen verändern könnte.
Eine Handsäge, ein Holzstemmeisen (Abb. 2) und ein Hammer sind wichtige Hilfsmittel, um aus den Stämmen die Scheibchen zu gewinnen und diese dann auf eine Größe (Abb. 3) zu bringen, so dass sie in die Öffnung der Probenflasche passen. Dabei muss darauf geachtet werden, dass auch nach Monaten die Lage des Blöckchens einwandfrei erkannt werden kann, um in weiterer Folge die drei Grundschnittrichtungen richtig zuzuordnen. Als Erkennungsmerkmale eignen sich z. B. Rinde, Jahresringe, Totholz, Harzkanäle.
Bei Holz wird von der gängigen Fixierung mit AFE (Alkohol, Formalin, Eisessig) Abstand genommen, da diese zu einer Härtung der Probe führt. An dessen Stelle rückt eine Mischung nach Professor Schweingruber, die zu gleichen Teilen aus Ethanol 96 % Vol., Aqua dest. und Glyzerin gemischt wird. Diese Mischung führt durch das Glyzerin zu einer leichteren Schneidbarkeit der Proben.
Derartig fixierte Proben (Abb. 4) können über Jahre aufbewahrt werden, ohne die Färbeeigenschaften zu verändern, wie wir kürzlich an 10 Jahre alten Proben feststellen konnten.
Für den Fall, dass auch die Rinde im Schnitt gezeigt werden soll, empfiehlt es sich, die Proben in der Ruhephase der Pflanze (Winter) zu sammeln, da sie sich sonst leicht vom Stammholz löst







Das Anfertigen der Blöckchen wird mit dem Holzstemmeisen gemacht, die Blöckchen werden grob zugerichtet, die exakte, z. B. lotrechte Lage ist dabei entscheidend (Abb. 5). Die Kontrolle erfolgt mit der 10-fach Lupe oder – noch besser – mit dem Stereomikroskop.
Die Kanten werden mit einem Hartmetallschleifpad gebrochen (Handschleifpad). Dies dient dazu, um beim nächsten Fertigungsschritt eine belastbarere Klebefläche zu erhalten. Die Krafteinwirkung beim Schneiden mit dem Mikrotom-Messer, gerade bei härteren Hölzern, ist nicht zu vernachlässigen. Man verwendet Buchenklötzchen, um die Probe im Schraubstock des Mikrotoms an die erforderliche Position zu bringen.
Da sowohl fixiertes als auch frisches Material bearbeitet wird, ist die Wahl des richtigen Klebers nicht einfach. Die Tuben Uhu Superkleber haben sich in beiden Fällen sehr gut bewährt. Die Klebefläche wird zunächst mit einem feuchten Tuch abgewischt, der Kleber flächig aufgetragen und mit einer Leimzwinge/Klemme wird der erforderliche Anpressdruck erreicht (Abb. 6). Dann wird auf allen vier Seiten in den Randbereichen noch einmal Kleber aufgetragen, um die Klebeverbindung zu stärken. Der genannte Kleber ist nach 15 Minuten ausgehärtet, aber auf den Außenflächen immer noch feucht (was kein Problem darstellt).
Im nächsten Schritt wird die Probe mit dem Buchenholzblock in die Halterung des Mikrotoms geklemmt (Abb. 7).
Es können Einmalklingen, klassische Mikrotom-Messer oder Hartmetallmesser für die Holzprobenbearbeitung eingesetzt werden. Bei Bedarf wird die Probe in einer Wasser-Glyzerin-Lösung gekocht (Abb. 8) oder alternativ bedampft, um die Schneideigenschaften zu verbessern.
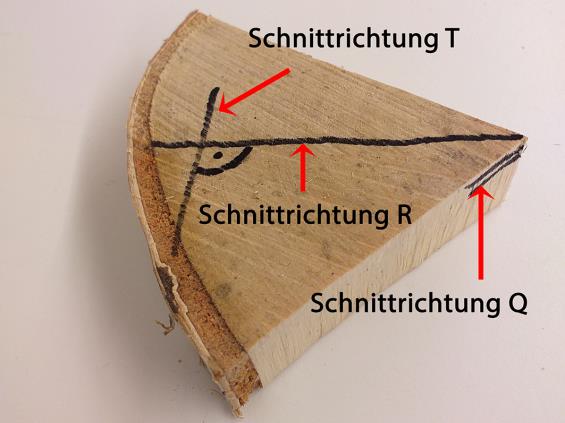
In der Bestimmung von Holz haben sich drei Standard-Schneiderichtungen etabliert. Dabei handelt es sich um die Orientierungen: Querschnitt „Q“ (es wird Scheibe für Scheibe vom Stamm abge- schnitten), Radialschnitt „R“ (verläuft durch das Zentrum des Holzes, parallel zu den Fasern) und Tangentialschnitt „T“ (verläuft in einem 90 Grad Winkel zum Radialschnitt). In Abb. 9 wird gezeigt, wie das Mikrotom-Messer für die jeweilige Schnittrichtung angesetzt werden muss.
Achtung: Holz wächst nicht immer symmetrisch, die Hauptwetterrichtung z. B. wirkt wesentlich auf den Wuchs ein und das Zentrum des Holzes kann damit außermittig sein.
Zur Gewinnung der Schnitte empfiehlt sich der Einsatz eines Schlitten- oder Grundschlittenmikrotoms (ein Rotationsmikrotom ist in diesem Fall ungeeignet), besonders wenn großformatige Fotografien der Schnitte angefertigt werden sollen. Bei solchen Aufnahmen (z. B. 30 cm x 45 cm) benötigt man größere Flächen des Präparates, die absolut planparallel sind. Ein scharfes Messer ist zwingende Voraussetzung für eine gute Schnittqualität, viele Einmalklingen erreichen die Schärfe eines frisch abgezogenen Mikrotom-Messers, bzw. eines Hartmetallmessers nicht. Zur Anwendung kommen die Messer-Geometrien „B“, „C“ und „D“.
Geschnitten wird in den Dicken 20 μ, 25 μ, 30 μ und 35 μ. Die gewählte Dicke richtet sich u. a. nach der Zellgröße der Probe. Für das Fotografieren benötigt man tunlichst dünne Schnitte, um möglichst keine Artefakte zu erzeugen, die beim Fokus-Stacking zwangsläufig auftreten.
Beim Schlittenmikrotom (Abb. 10) wird das Messer bewegt, beim Grundschlitten-Mikrotom hingegen steht das Messer still und die Probe wird in Richtung Messer bewegt. Der Grundschlitten ist stabiler, das ist besonders bei Hartholz ein Vorteil. Es wird immer mit einer möglichst langen Schneide geschnitten, das Messer wird dazu schräg gestellt (Abb. 11). Messer und Probe werden mit 30 %igem Alkohol befeuchtet, es gibt aber auch Experten, die auf eine Alkohol-Glyzerin-Mischung schwören.




Wenn sich Holzschnitte beim und/oder nach dem Schneiden einringeln, kann das zwei Gründe haben:
der Freiwinkel des Mikrotom-Messers ist zu gering
die Eigenspannung des Holzes
Um die 1. Ursache in den Griff zu bekommen, muss das Mikrotom-Messer steiler gestellt werden (Freiwinkel erhöhen). Um das 2. Problem zu verringern, werden Muttern als Gewichte auf die einzelnen Schnitte gelegt (Abb. 13). Bei besonders „hartnäckigen“ Proben müssen die Schnitte durch den gesamten Färbeprozess beschwert werden (z. B. zeigt die Eibe in Xylol die Tendenz sich wieder einzurollen). Meist reicht ein einmaliges Beschweren unmittelbar nach dem Schneiden.
Für die Überführung der Schnitte von einem Bad in das nächste wird eine SMD Werkzeugpinzette eingesetzt (Abb. 14). Diese ist aus nicht magnetisierbarem Material und stellt damit mit den Muttern kein Problem dar. Weiters ist entscheidend, dass die Pinzette vorne keine Häkchen besitzt, denn diese würden Löcher in den Schnitten verursachen.
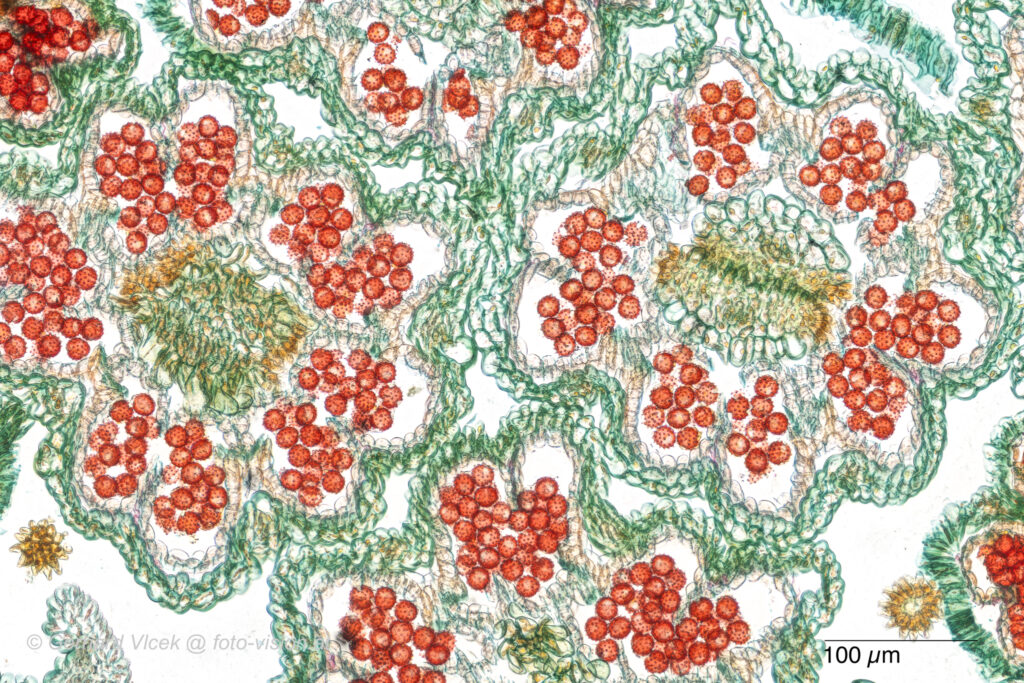
Es gibt unterschiedliche Färbemethoden, von der Einfachfärbung wie z. B. Safranin, Sudan III, Etzold Blau (Abb. 16), Etzold Grün bis zu den sogenannten Mehrfachfärbungen wie z. B. W3A (dreiteilige Färbung nach Robin Wacker, bestehend aus Arcridinrot, Acriflavin, Astrablau) (Abb. 15).
Womit gefärbt wird, ist von der Fragestellung, vom Geschmack und vom gewählten Betrachtungsverfahren abhängig. Meistens wird Durchlicht eingesetzt, immer häufiger werden aber auch Fluoreszenzanregung wie z. B. Blau oder Violett verwendet, bei Hölzern mit Oxalat-Kristallen ist die Kreuzpolarisation das Mittel der Wahl. Die heutzutage gängigsten Färbungen in der Durchlicht- mikroskopie sind Etzold Blau – auch als FCA bezeichnet – und Safranin.
Bei der Färbung werden mehrere Bäder der Reihe nach durchlaufen (Abb. 15 und 16).




Einer der wichtigsten Schritte bei der Färbung ist die Differenzierung und folgt nach der eigentlichen Färbung. Zur Differenzierung werden Aqua dest., Ethanol, Isopropyl-Alkohol (im weiteren als ISO bezeichnet), Salzsäure und viele mehr eingesetzt. Bei den in den Abbildungen gezeigten Färbevarianten wurde in beiden Fällen Aqua dest. und ISO verwendet. In Abb. 17 ist sehr gut ersichtlich, wie stark das Rot-Violett ausgezogen wird. Das ISO-Bad wird bei allen Färbevarianten 3 x wiederholt, dann kommt 2 x Terpineol und 3 x Xylol (Abb. 18). Diese 5 letzten Schritte dienen der Entwässerung. Ein weiteres Bad folgt mit einer Mischung aus Xylol und Eukitt (dem eigentlichen Eindeckmittel), wobei das Mischungsverhältnis je nach Neigung des Präparates zur Lufteinschlussbildung variiert wird.
Wenn die Probe einen hohen Harzanteil aufweist (das kommt bei einem Teil der Nadelhölzer vor), muss vor dem Färben gebleicht werden (z. B. mit Chloralhydrat). Die Bleichdauer hängt von vielen Faktoren ab (z. B. Schnittdicke, Lösungsverdünnung und Temperatur der Lösung), es empfehlen sich Vorabtests. Wenn es schneller gehen soll, kommt die Lösung auf die Labor-Heizplatte bei 40 Grad Celsius. Damit dauert das Bleichen 1 bis zu 3 Stunden, ansonsten bei Raumtemperatur eine Nacht. Die Lösung ist in beiden Fällen eine 10 %ige Chloralhydrat-Lösung.
Meist wird mit Eukitt eingedeckt (Abb. 19), das keine Eigenfluoreszenz zeigt und somit für UV-Anregung geeignet ist. Eigenfluoreszenz würde sich in Form einer Farbnebelschicht bei der Betrachtung oder Aufnahme auswirken. Die eingedeckten Schnitte werden beschwert (Abb. 20), um eine möglichst geringe Schichtdicke zwischen Probe und Deckglas zu erreichen. Das erlaubt ein Arbeiten mit Objektiven jenseits der 20x Vergrößerung (40x, 60x und 100x). Die Gewichte werden nach ein bis zwei Stunden entfernt und die Proben im Trockenschrank bei ca. 50 Grad getrocknet. Als Trockenschrank haben sich alte Sterilisatoren, die mit Umluft arbeiten bestens bewährt. Wird ein Objektträger zu schnell aufgestellt, wenn das Eindeckmittel noch nicht ausgehärtet ist, kann sich die Lage oder Form der Probe verändern. Vollständiges Aushärten ist auch für die Fotoqualität ein wesentlicher Einflussfaktor (Klarheit).
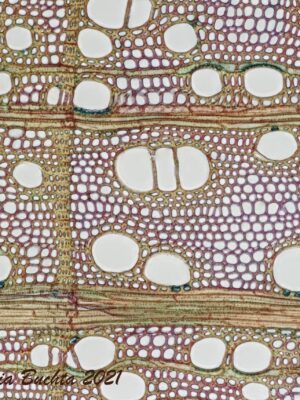
Entstehung der drei Schnittlagen von Berg-Ahorn (Acer pseudoplatanus)
Die Proben stammen aus dem Windbruch in der Umgebung von Kefermarkt (OÖ). Im Zuge einer Veranstaltung zum Thema Mikrofotografie wurden die Schnitte von Gerhard Zimmert in Blöckchen vorbereitet und am Jung HN-40 Schlittenmikrotom mit einem C Hartmetallmesser in den drei Schnittrichtungen quer (Q), tangential (T) und radial (R) geschnitten. Die Schnittdicke liegt bei 25 μ (Q) und 35 μ (R & T). Diese Proben wurden dann in Ethanol 70 % Vol. aufbewahrt und unmittelbar vor dem Fotografieren gefärbt. Aus den Schnitten wurden jeweils 2 Präparate je Schnittrichtung in Wacker 2-teilig gefärbt und mit dem Eindeckmittel Eukitt eingedeckt.
Die Fotos entstanden mit einer Canon 1DMkIV (Crop-Faktor 1,3) auf einem Olympus BH2 Durchlicht Mikroskop mit Fotoadaption. Das verwendete Objektiv ist ein Olympus DPlan APO 20UV NA 0,7 und das Projektiv ist ein NFK 1,67.
Die Aufnahme wurde mit einem Stack Shot Schrittmotor automatisiert durchgeführt. Die Anzahl der verwendeten Schichten war bei T 73, R 62 und bei Q 34.
Für die Berechnung der Stacks wurde die Software Helicon Focus eingesetzt. Tests im Vorfeld mit der Stacking Software Zerene haben sich für diese Motive als ungeeignet erwiesen, da sich Probleme in der Berechnung der Feinstrukturen, bei den sich überkreuzenden Linien des Holzes, ergeben haben. Retusche und Optimierung erfolgte in Affinity Foto.


Literatur (kleiner Auszug)
Gärtner, Holger und Schweingruber, Fritz H.: Microscopic Preparation Techniques for Plant Stem Analysis; ISBN 9783941300767
Gregus, Pál: Holzanatomie der Laubhölzer und Sträucher (1959)
Grosser, Dietger: Die Hölzer Mitteleuropas; ISBN 3935638221
Miggel, Bernd: Holzbestimmung mit dem Mikroskop; ISBN 978-930167-81-4
Schweingruber, Fritz H.: Microscopic Wood Anatomy – Mikroskopische Holzanatomie – Anatomie microscopique du bois; ISBN 978-3-945941-13-3