1 Der Redwood Nationalpark
Der Küstenmammutbaum (Sequoia sempervirens, engl.: Coastal Redwood) ist aufgrund seiner Höhe, seiner Größe und seiner Langlebigkeit in meinen Augen eine der eindrucksvollsten Baumarten. Sein Hauptvorkommen ist im nördlichen Kalifornien, wo er entlang der Pazifikküste zwischen San Jose und der Grenze zu Oregon bevorzugt wächst. Mit einer Stammhöhe von bis zu 115m ist er die weltweit am höchsten wachsende Baumart. Der Küstenmammutbaum ist ein naher Verwandter des Riesenmammutbaums (engl.: Giant Sequoia), der seine Heimat ebenfalls in Kalifornien hat und als mächtigste Baumart gilt. Weiters wachsen die ältesten Bäume der Welt (Grannenkiefern – engl.: Bristlecone Pines) ebenfalls in Kalifornien. Für Natur- und Waldliebhaber ist der Bundesstaat also das ideale Reiseziel.
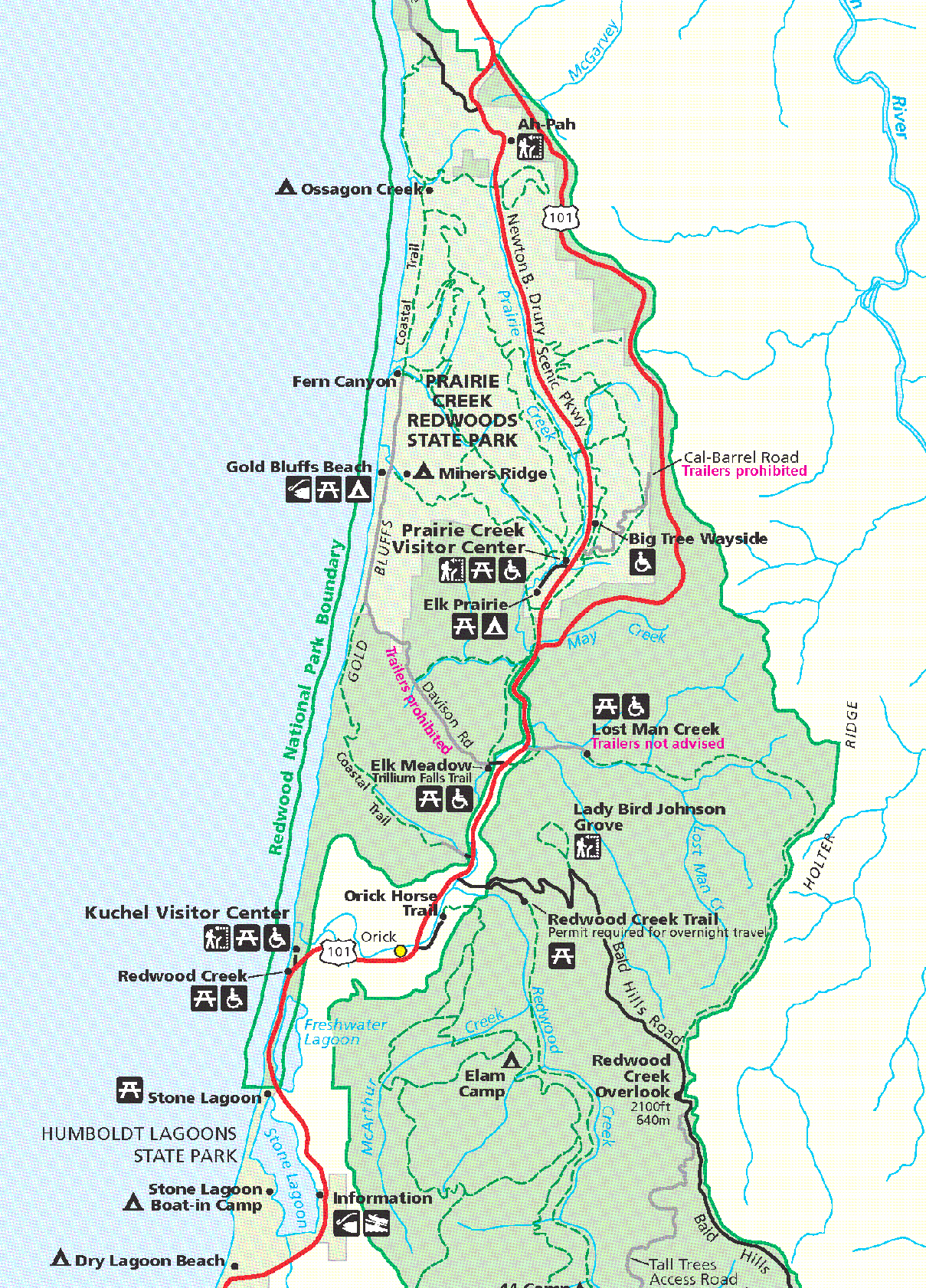
Abbildung 1: Karte des zentralen Teils des Redwood National Parks. Quelle: Wikimedia, gemeinfrei
Das Holz des Küstenmammutbaums war (und ist) aufgrund seiner Bearbeitbarkeit und Widerstandsfähigkeit sehr begehrt, sodass von den ursprünglich ausgedehnten Redwood-Wäldern (aufgrund des rötlichen Holzes entstand die englische Bezeichnung) nur mehr Restbestände vorhanden sind. Die verbliebenen Wälder sind heute zu einem großen Teil geschützt, und wer am Highway 1 von San Francisco nach Norden fährt, kommt an zahlreichen State Parks vorbei, in denen man diese eindrucksvollen Baumgestalten bewundern kann.
Besonders eindrucksvoll ist der Redwood-Nationalpark ganz im Norden Kaliforniens. Mit einer Größe von über 500km² ist er das größte Schutzgebiet dieser Art. Der Park liegt direkt am Pazifik (Abbildung 1) und bietet herrliche Wanderungen in eindrucksvollen Wäldern, deren Endpunkt direkt an der Küste liegt (Abbildung 2). Aufgrund der Abgeschiedenheit und der großen Entfernung zu den bevölkerungsreichen Zentren Kaliforniens ist der Nationalpark im Vergleich zu den bekannteren Parks (Yosemite Nationalpark, Sequoia-Kings Nationalpark) vergleichsweise wenig besucht.


Abbildung 2: Der Redwood National Park liegt direkt am Pazifik.
Der Großteil der hier gezeigten Bilder ist auf einer Wanderung vom Prairie Creek Visitor Center zum Fern Canyon entstanden. Da die Mitnahme von Material im Nationalpark verboten ist, wurden die Materialien (Nadeln, Holz, …) für die im Folgenden gezeigten Mikroskopie-Aufnahmen in einem Waldstück außerhalb des Nationalparks gesammelt. Der Spross aus Abbildung 5 b wurde in einem Park in der Wiener Innenstadt gesammelt.
In der Wintersaison 2022/23 haben schwere Winterstürme eine Schneise der Verwüstung durch Teile der Redwood-Wälder geschlagen. Viele uralte Bäume, die hier schon lange vor der Ankunft der Europäer gewachsen sind, wurden durch den Winddruck umgeknickt (Abbildung 3, rechts). Nach den schweren Waldbränden im Jahr 2021, bei denen speziell in der Gegend um San Francisco große Redwood-Bestände vernichtet wurden, ist das ein weiterer Rückschlag für die Erhaltung dieser Art.



Abbildung 3: Der Autor vor einem Redwood-Baum (links). Der Name der Bäume rührt von der rötlichen Farbe des Holzes her (Mitte). Durch Winterstürme umgeknickter Baum am Wanderweg (rechts).
Durch das spezielle Klima bietet die Gegend die idealen Wachstumsbedingungen für diese mächtigen Baumriesen (Abbildung 4). Wer genau auf die linke Aufnahme in Abbildung 4 schaut, wird zwei kleine „Hobbits“ finden, welche die Baumriesen bestaunen und in den umgebenden Farnen nur schwer auszumachen sind. Die Proportionen geben einen Eindruck von der Größe und Mächtigkeit dieser Baumart.


Abbildung 4: Landschaftseindruck bei einer Wanderung in den Redwood-Wäldern. Man beachte den Größenvergleich zu den kaum erkennbaren Wanderern.
2 Spross und Nadeln
Das besondere Klima entlang Nordkaliforniens Küsten hat zu einer Adaption der Nadeln bei den Küstenmammutbäumen geführt. Der Wechsel von niederschlagsarmen, aber teilweise nebligen Sommern zu feuchten Wintern stellt spezielle Anforderungen an die Nadeln. Einerseits muss verhindert werden, dass ein permanenter Wasserfilm auf den Nadeln den Gasaustausch über die Spaltöffnungen behindert, andererseits benötigen die Bäume in der warmen, aber trockenen Sommersaison eine ausreichende Wasserversorgung. Diese Anforderungen löst der Küstenmammutbaum durch die Ausbildung von zwei unterschiedlichen Nadeltypen [2, 3]: Der erste Typus ist in vor allem für das „Einsammeln“ von Feuchtigkeit aus den sommerlichen Nebelbänken zuständig. Die entsprechenden Nadeln ordnen sich, siehe Abbildung 5 a, schuppenförmig um den Spross an und sind spitz zulaufend. Die Spaltöffnungen sind in dieser Abbildung als feine weiße Punkte erkennbar.


Abbildung 5: Schuppige Nadeln (a), welche Feuchtigkeit aus Nebelbänken aufnehmen können und fächerartige Nadeln (b), die effizient Sonnenlicht absorbieren
Der zweite Typus ist in erster Linie auf eine effiziente Nutzung des einfallenden Sonnenlichts hin optimiert. Die Nadeln (Abbildung 5 b) sind fächerförmig um den Spross angeordnet und weisen eine vergleichsweise große Oberfläche auf. Die Spaltöffnungen befinden sich bei diesem Nadeltyp auf der Unterseite. Die Kombination dieser zwei Nadeltypen ermöglicht es dem Baum, seinen Wasserbedarf im trockenen Sommerhalbjahr aus der Feuchtigkeit des Küstennebels zu gewinnen und gleichzeitig mit dem zweiten Nadeltypus effizient Photosynthese zu betreiben.
Für mikroskopische Aufnahmen war die Herstellung dünner Schnitte erforderlich, um gefärbte Proben im Hellfeld beobachten zu können. Die Sprosse mit den schuppenförmigen Nadeln lassen sich nur recht schwer mit dem Mikrotom schneiden. Es wurde deshalb eine Einbettung in PEG (siehe Abschn. 4.2) angewandt, um vollständige und ausreichend dünne Schnitte der Sprosse herzustellen. Geschnitten wurde auf einem Reichert Schlittenmikrotom, die Färbung erfolgte gemäß dem in Abschn.4.1 angeführten Protokoll.

Abbildung 6: Querschnitt durch einen Spross mit abzweigenden Nadeln. Schnittdicke 30µm, Färbung nach Wacker.
Das Ergebnis eines solchen Schnittes (Schnittdicke 30µm) ist in Abbildung 6 dargestellt: Deutlich erkennbar ist das blau gefärbte Mark im Inneren des Sprosses, welchem nach außen hin die rot gefärbten, verholzten Bereiche folgen. Jede der abzweigenden Nadeln ist mit einem Harzkanal versehen. Die Aufnahme ist ein Panorama aus 4 Einzelaufnahmen, die jeweils mit einem 5x-Objektiv aufgenommen wurden.

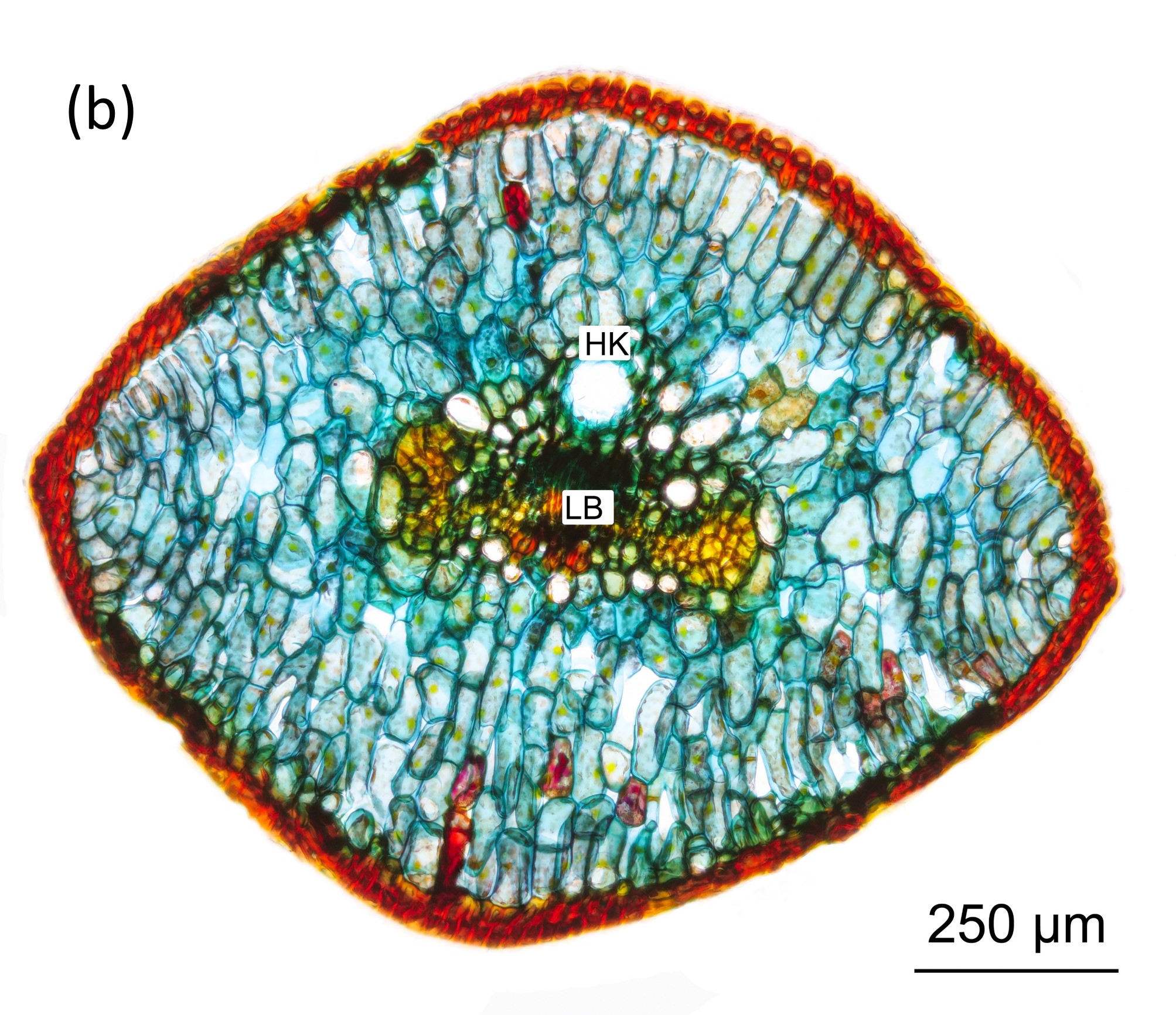
Abbildung 7: Querschnitt durch eine Nadel an der Nadelspitze (a) und an der Nadelbasis (b).
In Abbildung 7 sind zwei Querschnitte durch eine der Schuppennadeln dargestellt. Nahe der Sprossabzweigung (b) ist der Querschnitt rhombisch. Gut zu erkennen sind der Harzkanal HK und das Leitbündel LB. Nach oben hin verjüngen sich die Nadeln und nehmen eine sichelförmige Gestalt an (a).
Abbildung 8 ist ein Längsschnitt durch eine Nadel, die nach Einbettung in PEG geschnitten wurde. Die Aufnahme in (a) ist ein z-Stapel (4 Einzelbilder), die mit einem Leica HC PL Fluotar 10x-Objektiv aufgenommen wurden. Färbung war wiederum Wacker. Man erkennt schön das lockere Schwammgewebe, welches Ursache für die schlechte Schneidbarkeit der Nadeln ist. Ebenfalls erkennbar sind einige Spaltöffnungen (rot gefärbt). Abbildung 8b zeigt eine Detailaufnahme aus dem Längsschnitt bei höherer Vergrößerung (40x-Objektiv). Hier sind die Spaltöffnungen (SÖ) sehr deutlich erkennbar.

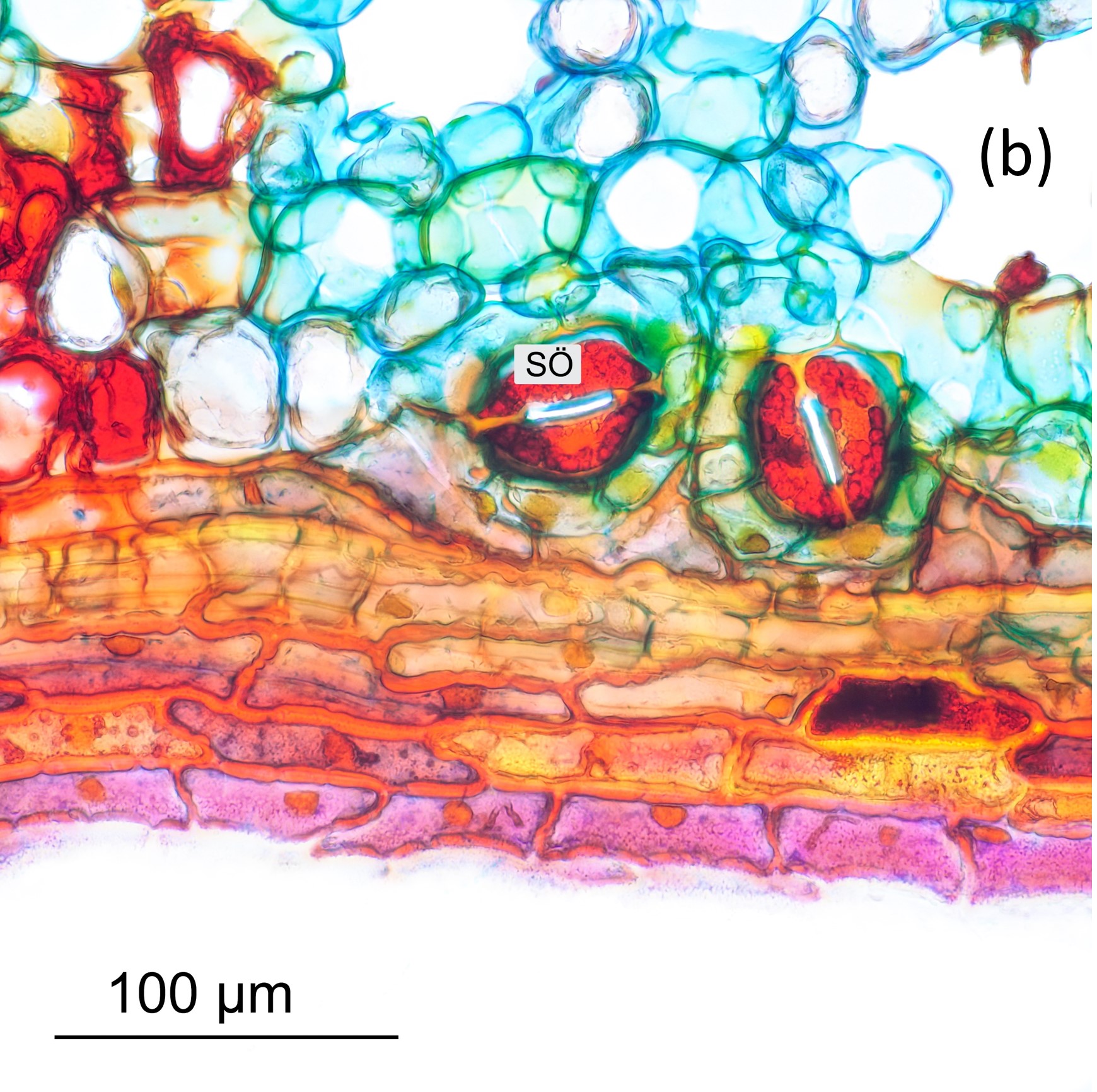
Abbildung 8: Längsschnitt einer Schuppennadel.
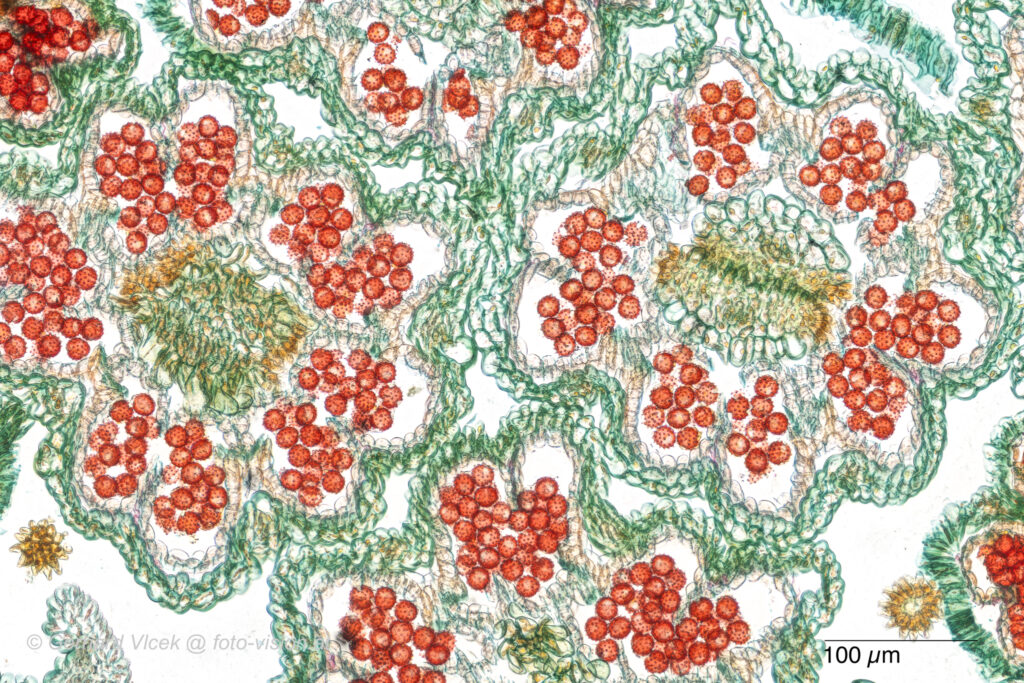
Wie zu erwarten, zeigen die fächerartigen Nadeln aus Abbildung 5b einen etwas anderen Aufbau: In Abbildung 9a ist der Querschnitt einer solchen Nadel zu sehen. Die Einfärbung erfolgte ebenfalls gemäß dem in Abschn. 4.1 und 4.2 beschriebenen Protokoll. Schnittdicke war wiederum 30µm. Das Leitbündel sowie der Harzkanal sind sehr gut erkennbar, ebenso das Palisadenparenchym (PP), welches grün eingefärbt ist. Das Schwammparenchym (SP) erscheint hingegen eher bläulich. Abbildung 9b, aufgenommen mit einem 20x-Objektiv, zeigt ein Detail um das Leitbündel eines solchen Nadelquerschnittes.
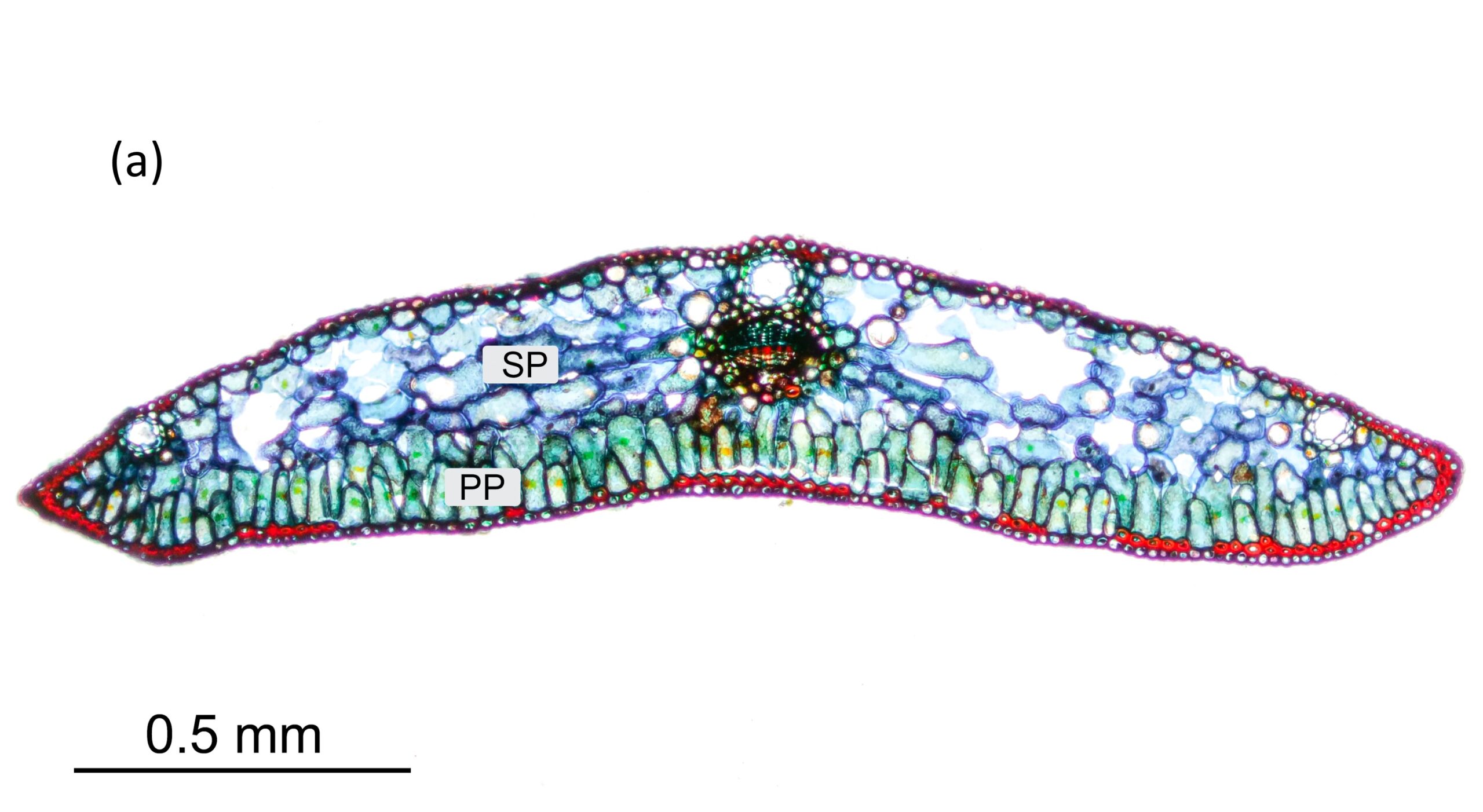

Abbildung 9: Querschnitt der fächerartigen Nadeln, siehe Abbildung 5 b.
3 Holz
Vor dem Schneiden wurden die Holzklötzchen (ca. 2x2x2cm³) für mehrere Tage in einer Lösung aus 1:1:1 Ethanol-Glyzerin-Wasser gelagert. Danach lässt sich das Holz trotz seiner ursprünglich hohen Härte sehr gut schneiden. In allen 3 Schnittrichtungen konnte ich am Schlittenmikrotom problemlos Schnitte mit 20µm Dicke herstellen. Man muss nur darauf achten, dass der Schnitt flach am Messer liegenbleibt und sich nicht einrollen kann. Die eingerollten Schnitte zu „entrollen“ ist kaum möglich.
Gefärbt wurden alle Schnitte mit Etzold-FCA Färbung. Dazu wurden die Schnitte kurz in Aqua dest. gereinigt und danach für 5min in der Färbelösung belassen. Die weitere Behandlung der Schnitte erfolgt in Analogie zur Vorgangsweise in Abschn. 4.1. Die erhaltenen Aufnahmen sind in Abbildung 10 dargestellt.Das verwendete Objektiv und die Orientierung (quer, tangential, radial) des Schnittes sind im jeweiligen Bild angegeben. Die Aufnahmen mit dem 10x-Objektiv sind Panoramen aus 4 Einzelbildern. Die Aufnahmen mit dem 40x-Objektiv wurden gestapelt und aus 3-5 Aufnahmen in Helicon Focus zusammengefügt.
Im Querschnitt erkennt man deutlich den Unterschied zwischen Frühholz (FH) und Spätholz (SH). Ebenfalls ersichtlich sind die Holzstrahlen (HS), die vom Stammzentrum nach außen führen. Das Holz weist ein Axialparenchym (AP) auf, welches in den Aufnahmen blau erscheint. Bei höherer Vergrößerung sind die Schraubenverdickungen der Tracheiden (TS) erkennbar. Auch in Tangential- und Radialrichtung wurden Schnitte gemacht. Im Tangentialschnitt sieht man, dass die Holzstrahlen eine Zelle breit und typischerweise 3-5 Zellen hoch sind. Im Radialschnitt ist ersichtlich, wie die Holzstrahlen durch die Jahresringe hindurchlaufen. Bei höherer Vergrößerung werden einzelne Hoftüpfel (HT) sichtbar.
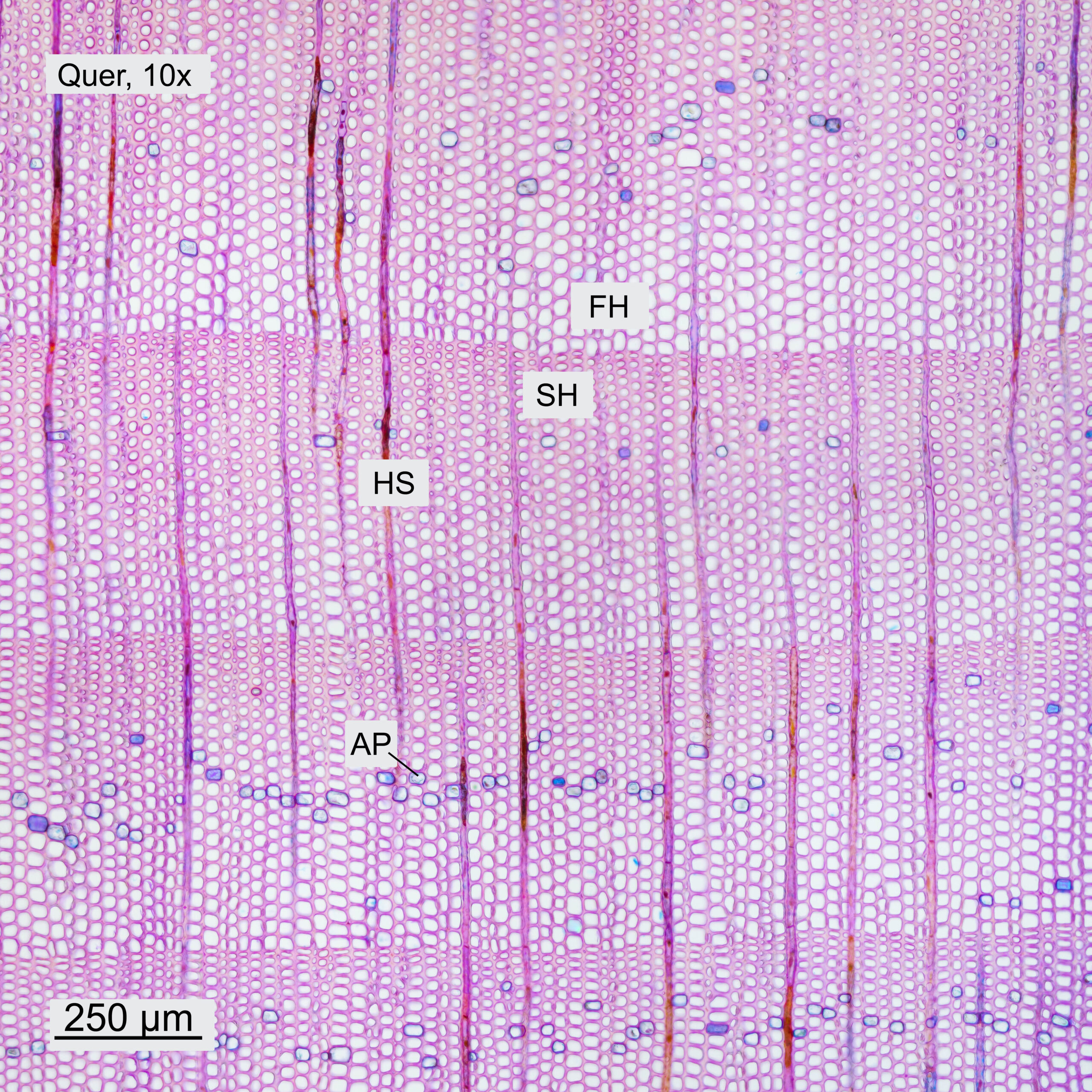

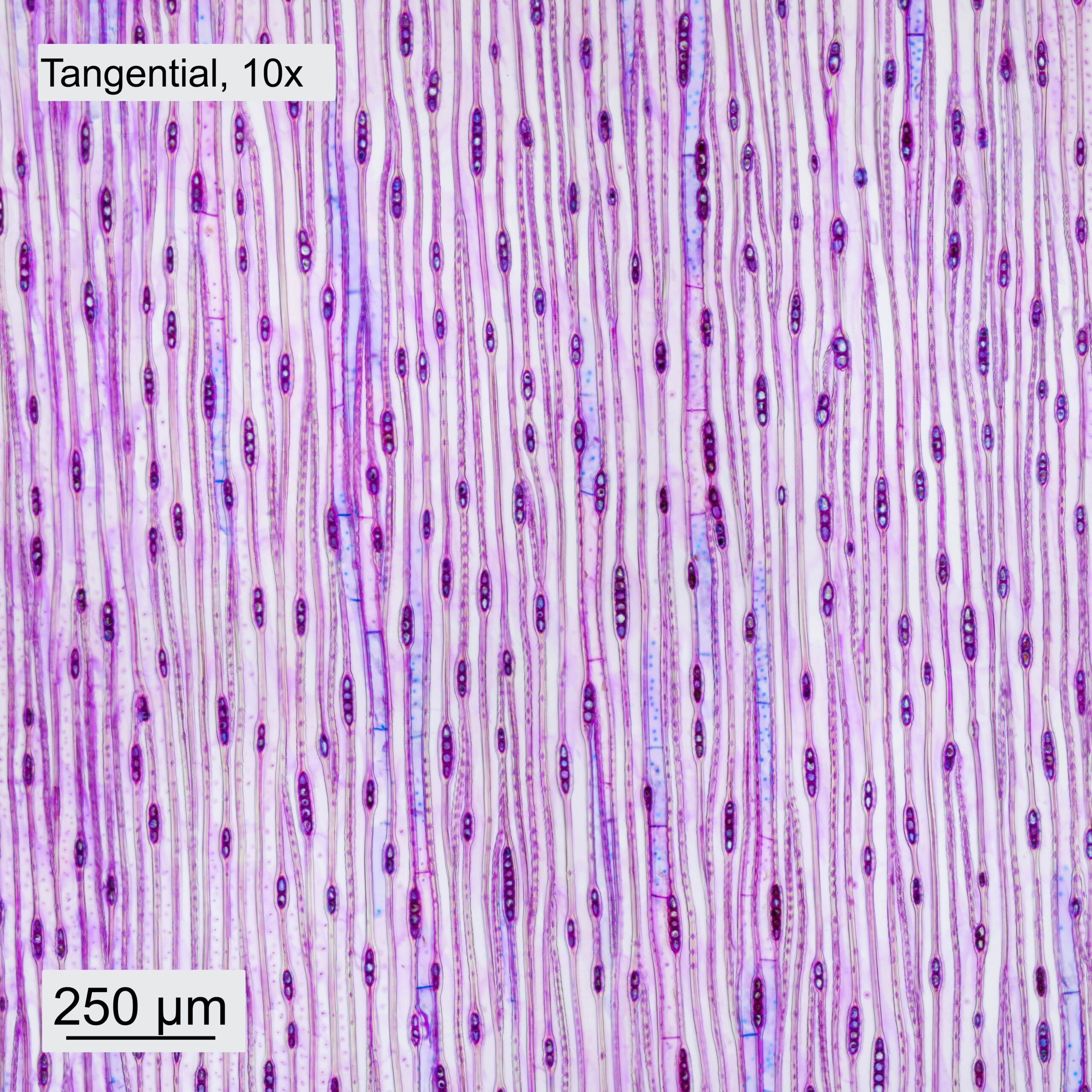
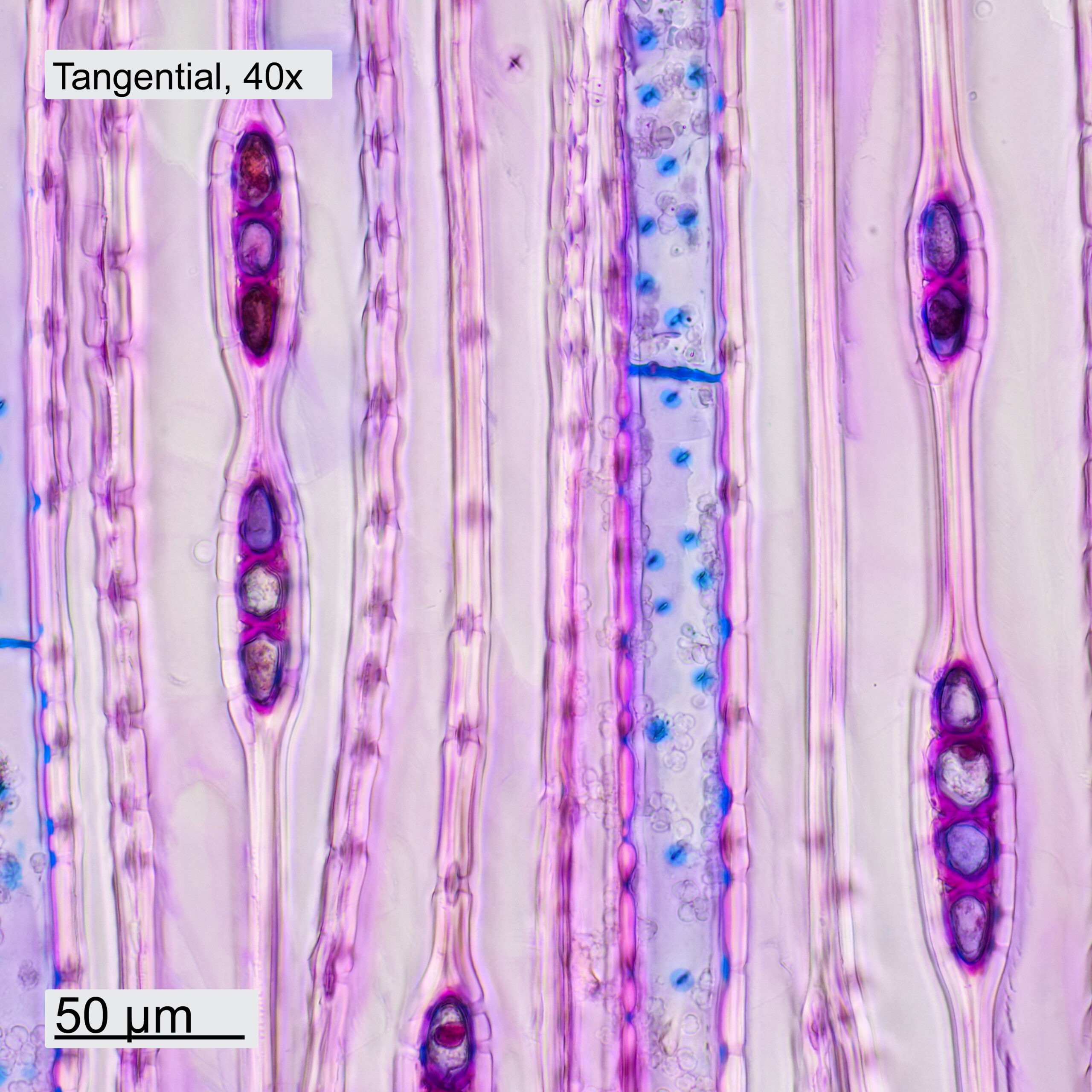

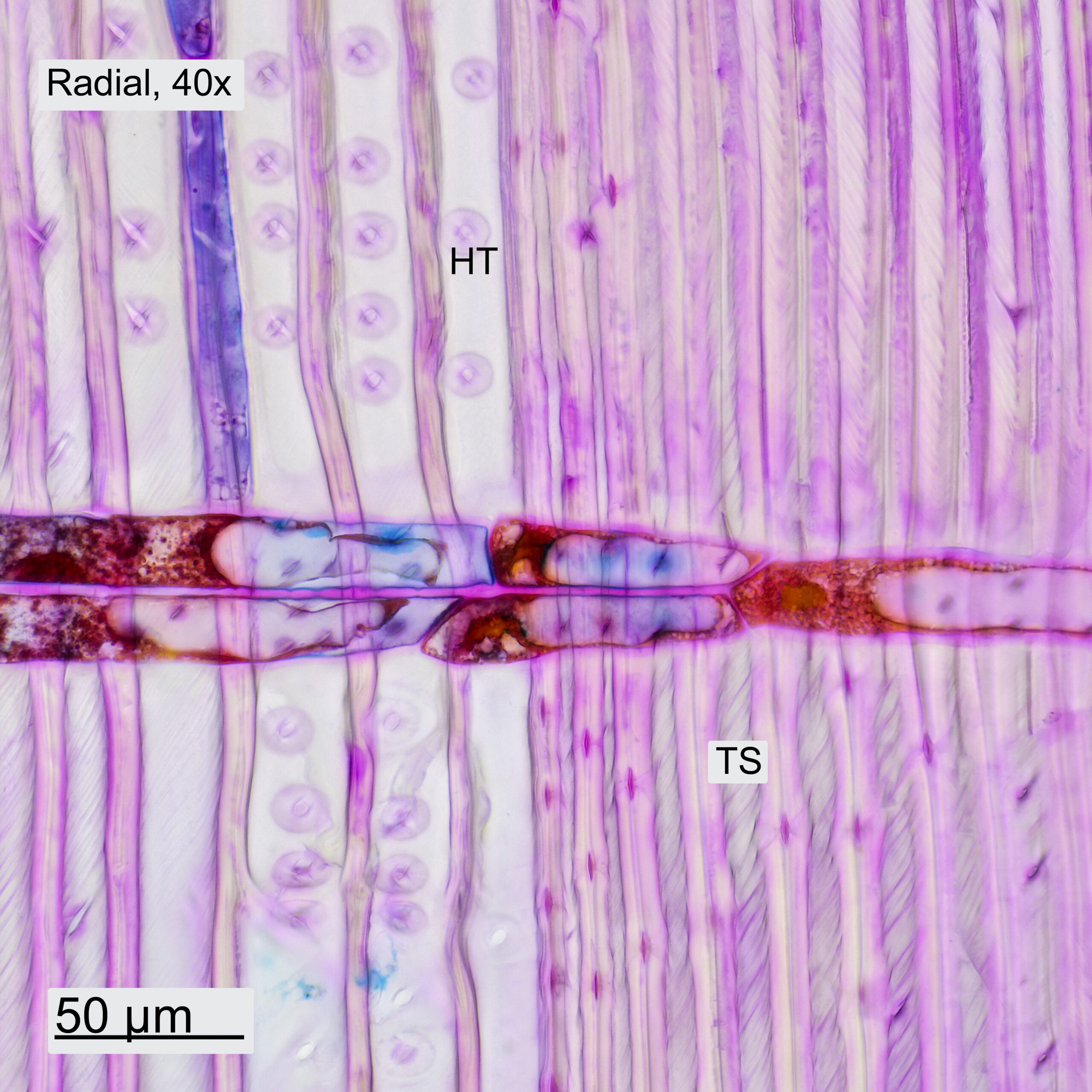
Abbildung 10: Schnitte durch das Holz des Küstenmammutbaums, jeweils mit 10x- und 40x-Objektiven aufgenommen.
4 Präparations- und Färbeprotokolle
4.1 Wackerfärbung
Die Proben werden in AFE (Alkohol-Formalin-Essigsäure) zumindest 24h fixiert und danach in 70% Ethanol gelagert. Geschnitten wird am Schlittenmikrotom in Dicken zwischen 25 und 50µm. Die Schnitte werden in Aqua dest. überführt, um Lösungsmittelrückstände zu entfernen. Danach erfolgt die Färbung entsprechend folgendem Protokoll. Die Zusammensetzung der Farbstofflösungen entspricht den in [4] genannten Ansätzen.
- 5min Färbung in Acridinrot-Lösung
- Reinigung in Aqua dest. bis keine Farbwolken mehr abgehen
- 20sec Färbung in Acriflavin-Lösung
- Reinigung in Aqua dest. bis keine Farbwolken mehr abgehen
- 2min Färbung in Astrablau.-Lösung
- Überführung in Isopropanol in 3 Stufen. Die ersten zwei Stufen im schnellen Wechsel, um ein übermäßiges Ausziehen des roten Farbstoffes zu vermeiden. Ziel ist es, alles Wasser zu entfernen, um Probleme beim Eindecken zu vermeiden.
- Eindecken in Euparal.
4.2 PEG-Einbettung
Mithilfe der Einbettung in Polyethylenglykol (PEG) ist es möglich, empfindliche Proben zu schneiden, die ohne Einbettung nicht ausreichend dünn geschnitten werden können bzw. beim Schneiden zerstört werden. PEG ist ein wasserlösliches Wachs, welches nach dem Schneiden der Proben unkompliziert in einem wässrigen Medium entfernt werden kann. Es ist darauf zu achten, dass sowohl beim Einbetten als auch beim Entfernen des PEG ausreichend langsam vorgegangen wird, um eine Schädigung der Probe bzw. der Schnitte zu vermeiden. PEG diffundiert aufgrund seines hohen Molekulargewichts deutlich langsamer in die Probe hinein (bzw. heraus) als Wasser. Ist der dadurch entstandene Konzentrationsgradient zu groß, können Proben oder Schnitte deformiert werden oder gar reißen. Die unten angegebenen Zeiten und Konzentrationen müssen deswegen bei Bedarf an das jeweilige Probenmaterial angepasst werden. Für viele botanische Proben hat sich das folgende Protokoll als geeignet erwiesen:
- Lagern der Proben für 12h in 20% PEG 1500, 80% Aqua dest.
- Lagern der Proben für 12h in 50% PEG 1500, 50% Aqua dest.
- Lagern der Proben für 12h in 100% PEG 1500 bei 60°C
- Wechseln auf frisches PEG und weitere 12h in 100% PEG 1500 bei 60°C
- Einbetten der Proben in geeignete Formen
- Schneiden mit dem Schlittenmikrotom
- Die Schnitte für die Entfernung des PEG für ca 5min in 20% PEG 1500, 80% Aqua dest. geben
- Schnitte in Aqua dest. überführen und je nach Färbeprotokoll weiterverarbeiten
4.3 Präparation und Aufnahmetechnik
Alle Mikroskopie-Aufnahmen wurden mit einem Leica DM 2000LED mit HC PL Fluotaren aufgenommen. Als Kamera wurde eine Panasonic G9 verwendet. Alle Schnitte wurden auf einem Reichert Schlittenmikrotom (siehe Abbildung 11) mit Leica Einwegklingen durchgeführt.

Abbildung 11: Schneiden von 20µm dicken Holzschnitten am Schlittenmikrotom.
5 Literatur
[1] Küstenmammutbaum (Sequoia sempervirens), Spross, Nadel, Holz. https://www.mikroskopie-forum.de/index.php?topic=46398.0, aufgerufen am 21.12.2023
[2] A. Chin, Redwood trees have two types of leaves, scientists find – a trait that could help them survive in a changing climate, https://theconversation.com/redwood-trees-have-two-types-of-leaves-scientists-find-a-trait-that-could-help-them-survive-in-a-changing-climate-179812, aufgerufen am 21.12.2023
[3] Chin, A. R. O., P. Guzmán‐Delgado, S. C. Sillett, J. Orozco, R. D. Kramer, L. P. Kerhoulas, Z. J. Moore, M. Reed, und M. A. Zwieniecki. 2022. Shoot dimorphism enables Sequoia sempervirens to separate requirements for foliar water uptake and photosynthesis. American Journal of Botany 109(4):564–579. https://doi.org/10.1002/ajb2.1841
[4] W-3A-Färbung nach Wacker, http://www.aeisner.de/methoden/farb117.html, aufgerufen am 21.12.2023