1 Wozu der ganze Aufwand?
Während die Paraffintechnik in der Histologie weit verbreitet ist und routinemäßig im klinischen Alltag zum Einsatz kommt, sind Paraffinschnitte in der botanischen Mikrotechnik eher eine Randerscheinung. Das hat vermutlich zwei Ursachen:
- Die Probenvorbereitung ist recht aufwändig: Das zu untersuchende Material muss über mehrere Zwischenschritte vollständig entwässert werden, damit eine Einbettung in Paraffin möglich wird. Im Anschluss muss der Paraffinblock mit einem geeigneten Rotationsmikrotom geschnitten werden, um die Schnitte auf Objektträger aufziehen zu können. Das Paraffin auf dem Objektträger kann dann entfernt werden, und die Probe wird wiederum über mehrere Zwischenschritte in ein wässriges Milieu übergeführt, um eine Färbung mit den handelsüblichen Farbstoffen zu ermöglichen. Der gesamte Vorgang dauert mehrere Tage und erfordert teils gesundheitsschädliche bzw. geruchsintensive Chemikalien wie Xylol oder Methylbenzoat. Ein gut belüfteter Arbeitsplatz ist daher erforderlich. Konventionelle botanische Handschnitte bzw. Schnitte mit dem Schlittenmikrotom, die mit Frischmaterial durchgeführt werden können, liefern Ergebnisse innerhalb weniger Stunden und erfordern in der Regel nur haushaltsübliche Chemikalien.
- Die Größe einer typischen pflanzlichen Zelle liegt bei ca. 50 µm und ist damit deutlich größer als die meisten tierischen Zellen, deren Größe üblicherweise bei ca. 10 µm liegt. In den meisten Fällen wird man Schnittdicken wählen, welche dieselbe Größenordnung aufweisen wie die untersuchten Zellen. Bei Pflanzenproben (Sprossachse, Holzschnitte, Blätter, …) wird man vielfach Schnittdicken im Bereich von 30-50µm wählen, die sich bei vorhandenem handwerklichen Geschick und mit einiger Übung recht einfach mit Hand- oder Schlittenmikrotomen umsetzen lassen. Falls dünnere Schnitte erforderlich sind, ist die Einbettung über PEG eine Option. [1] Mit in PEG eingebetteten Proben können minimale Schnittdicken von 15-20 µm realisiert werden.
In einigen Fällen ist man in der Botanik mit Proben konfrontiert, die entweder nicht zusammenhängende Strukturen aufweisen oder Schnittdicken zwischen 5 und 15 µm erfordern. Als Beispiele erwähnt seien hier Blüten mit ihren teils sehr kleinen Pollen oder Pilze, deren Sporen und Hyphen Durchmesser im einstelligen Mikrometer-Bereich aufweisen. Neben diesen rein geometrischen Aspekten bietet die Paraffintechnik aber auch Vorteile in Hinblick auf die Möglichkeit, interessante geometrische Formationen (z.B. Blüten- oder Blattknospen) „einzufrieren“ und so nach dem Schneiden Einblicke in einen faszinierenden Formenreichtum zu erhalten, der mit anderen Methoden nicht zugänglich ist. [2] Der technische Zusatzaufwand zahlt sich also aus und eröffnet viele Möglichkeiten, den Einfallsreichtum der Natur in farbenfrohen Bildern festzuhalten.
2 Ausrüstung und Arbeitsschritte
Die für diese Arbeit gewählte Ausrüstung wurde so gewählt, dass der Verbrauch an Chemikalien (Paraffin, Xylol, …) möglichst gering ist. Dadurch ist es ausreichend, Kleinmengen zu kaufen und zu lagern. Zusätzlich wird die Entsorgung vereinfacht, da die Abgabe von haushaltsüblichen Mengen in den meisten Gemeinden bei Problemstoffsammelstellen unkompliziert und in der Regel kostenlos ist.
25ml-Schnappdeckelgläser sind besonders praktisch. Sie können in einem Blockthermostat bei definierten Temperaturen über eine einstellbare Zeit gelagert werden und benötigen nur geringe Füllmengen an Lösungsmittel. Die verfügbaren Einsätze für Blockthermostate nehmen vier bis sechs Proben gleichzeitig auf, was eine Verarbeitung mehrerer unterschiedlicher Proben vereinfacht. Als kostengünstige Alternative zum Blockthermostat (siehe Abbildung 2‑1) ist grundsätzlich jede Laborheizplatte, auf welche die Einsätze gestellt werden, geeignet. Um die Paraffinblöcke schneiden zu können, ist ein Rotationsmikrotom (siehe Abbildung 2‑2) erforderlich. Ein Strecktisch und Streckbad sind sehr hilfreich, können aber gegebenenfalls durch ein Wasserbad auf einer Laborheizplatte bzw. auf einem Alublock, der ebenfalls auf einer Laborheizplatte aufliegt, ersetzt werden.

Abbildung 2‑1: Gerätschaften (Einbettformen, Einbettkassetten, Rollrandgläser, Blockthermostat) zur Vorbereitung der Paraffinblöcke.

Abbildung 2‑2: Erforderliche Ausrüstung für das Schneiden und Strecken der Proben.
Neben den üblichen Mikroskopie-Utensilien (Mikroskopierbesteck, Bechergläser, Laborheizplatte, Ethanol, Isopropanol, Eindeck- und Färbemittel) wurden somit folgende Gerätschaften für die Herstellung der hier gezeigten Präparate verwendet:
- Rotationsmikrotom mit Schmalband-Einwegklingen
- Streckbad und Strecktisch (optional, kann durch Laborheizplatte ersetzt werden)
- Blockthermostat mit Einsätzen für Rollrandgläser (optional, kann durch Laborheizplatte ersetzt werden)
- Rollrandgläser
- Färbeküvetten
- Exsikkator mit Vakuumpumpe zur Entfernung von Luftblasen
- Chemikalien: wasserfreies Ethanol, Xylol, Methylbenzoat und Paraffin
Eine der wesentlichen Herausforderungen bei der Paraffintechnik liegt darin, dass sich Fehler in einem der erforderlichen Prozessschritte in den nachfolgenden Schritten schwer oder gar nicht korrigieren lassen. D.h. jeder Fehler zieht sich erfahrungsgemäß bis ins fertige Präparat durch und senkt dessen Qualität. Die Paraffintechnik ist deshalb nichts für Ungeduldige, Rückschläge sind unvermeidbar. Irgendwann sitzen die einzelnen Handgriffe, und schöne Präparate sind dann der Lohn für die Mühen.
2.1 Probenvorbereitung
Ausgangspunkt für die Präparation sind frische botanische Proben (Blüten, Blätter, Wurzeln, …). Im ersten Schritt empfiehlt es sich, die Proben bereits im frischen Zustand so zuzuschneiden, wie sie im letzten Schritt in die Einbettformen eingelegt werden. D.h. der Durchmesser der Probe sollte nicht zu groß sein, und ihre Höhe sollte die Tiefe der Einbettform nicht überschreiten. Ein verbliebenes Stück vom Stängel kann hilfreich sein, um die Probe im flüssigen Paraffin leichter positionieren zu können.
Pflanzen und Pilze schützen sich mit ausgeklügelten Methoden, die verhindern sollen, dass ungewollt Medien aus der Umgebung ins Innere des Organismus eindringen. Diese Schutzschichten (z.B. Cuticula und Epidermis) erschweren damit das Durchdringen der Probe mit dem jeweiligen Medium. Es kann daher sehr hilfreich sein, die Probe mit einer Präpariernadel oder einem Skalpell an Stellen anzuschneiden, die später nicht im Paraffinschnitt zu liegen kommen (z.B. der untere Blütenboden einer Blüte).
2.2 Einbetten der Proben
Für die Einbettung der Proben wurde in dieser Arbeit ein Protokoll in Anlehnung an [3, S. 107] verwendet. Das Protokoll (siehe Tabelle 2‑1) kann als Ausgangspunkt für erste Versuche gesehen werden. Je nach Probenart und -beschaffenheit können Adaptionen erforderlich sein. Ausgangsmaterial sind jeweils in AFE (Alkohol-Formalin-Essigsäure) fixierte Proben, die im ersten Schritt möglichst vollständig entwässert werden müssen. Dazu werden die Proben in ein Rollrandglas gegeben und in reinem Ethanol für kurze Zeit getränkt, um einen Großteil des Wassers zu entfernen. Bei etwas schwierigeren Proben empfiehlt sich danach ein Zwischenschritt im Vakuum, um eventuelle Luftblasen zu entfernen, die den Kontakt des Lösungsmittels mit dem Probeninneren verhindern würden.
In einem weiteren Schritt wird wiederum reines Ethanol verwendet, das über mehrere Stunden für einen gründlichen Austausch des verbliebenen Fixierungsmittel mit Ethanol sorgt. Danach ist die Probe fast wasserfrei und kann in das Intermedium (in diesem Fall Methylbenzoat) gelegt werden.
Tabelle 2‑1: Typische Prozessschritte beim Einbetten botanischer Proben. Bei den mit * markierten Schritten kann es hilfreich sein, am Anfang des Schrittes Vakuum anzulegen, um eventuell vorhandene Luftblasen zu entfernen.
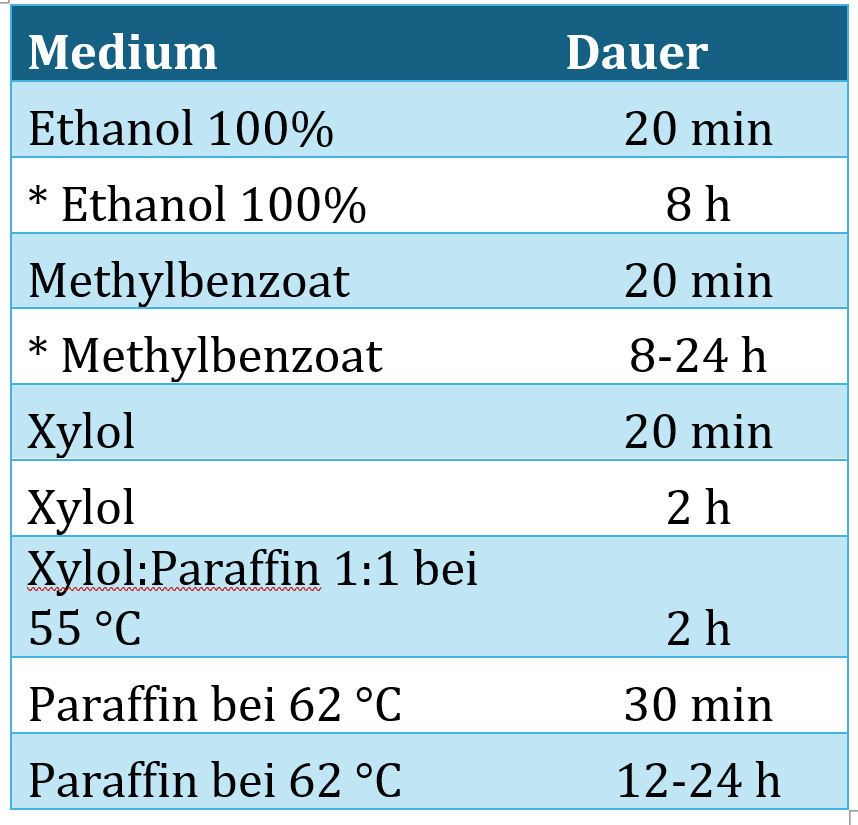
Methylbenzoat ist sowohl mit geringen Konzentrationen an Wasser als auch mit Xylol verträglich und ist somit ein geeignetes Medium, um von den polaren Medien Ethanol/Wasser in die unpolaren Medien Xylol/Paraffin überzugehen. Methylbenzoat ist in den verwendeten Mengen nicht gesundheitsschädlich, riecht aber selbst in kleinsten Mengen sehr intensiv. D.h. man sollte in diesem Schritt sehr sorgsam arbeiten, um ein Verschütten des Mediums zu vermeiden. Methylbenzoat hat einen hohen Brechungsindex und klärt die Proben, sie werden zum Teil durchsichtig. Kleine Luftblasen lassen sich in diesem Schritt daher gut erkennen und können damit im Vakuum leichter entfernt werden.
Falls beim Übergang zu Xylol noch kleinste Reste von Wasser vorhanden sind, wird das Lösungsmittel trüb, als Indikator für eine unvollständige Entwässerung. Am Ende der Prozesskette erhält man eine in flüssigem Paraffin eingebettete Probe, die weder nach Methylbenzoat noch nach Xylol riechen sollte, wenn alle vorherigen Schritte erfolgreich verlaufen sind. Die Proben können jetzt in vorgewärmte und mit flüssigem Paraffin gefüllte Einbettformen umgelagert werden. Oft ist es hilfreich, mit einer (Nieten)Zange ein Loch in den Kassettenboden zu schneiden, um eine Halterung zur Ausrichtung der Probe (z.B. Blütenstiel) zu haben.
Zum Schluss wird die Einbettkassette auf die Form gelegt und mit etwas zusätzlichem Paraffin bedeckt. Das Paraffin erstarrt, und nach kurzer Lagerung im Kühlschrank kann der Paraffinblock recht leicht aus der Form entfernt werden. Der Block kann mit einem Messer noch etwas zugeschnitten werden und ist dann bereit für das Schneiden. Es gibt eine Reihe von Paraffin-Anbietern, im Rahmen dieser Arbeit konnten die besten Ergebnisse mit dem Paraffin von Leica (Paraplast Plus) erreicht werden.
2.3 Schneiden der Proben
Für das Schneiden der Proben am Rotationsmikrotom (siehe Abbildung 2‑2) ist es hilfreich, wenn die Paraffinblöcke eine Temperatur unterhalb der Raumtemperatur haben. Das gilt besonders für härtere Proben (im Idealfall weisen Probe und Einbettmedium dieselbe Härte auf) und für dünne Schnitte (<5 µm). Man kann dazu den Paraffinblock in einen Kühlschrank geben bzw. in ein mit Eiswürfeln und Wasser gefülltes Gefäß, das neben dem Mikrotom steht.
Nach dem Trimmen der Probe werden Schnitte mit der gewünschten Dicke angefertigt, die idealerweise ein Schnittband bilden. Vielfach rollen sich die Schnitte ein. Um das zu vermeiden, ist es wichtig, den richtigen Messer-Freiwinkel zu finden, der für verschiedene Messertypen unterschiedlich sein kann Für die in dieser Arbeit verwendeten Schnitte wurden Einwegklingen von Leica (Typ 818) sowie von Feather (Typ S35) verwendet. Beide Messertypen lieferten gute Ergebnisse, mit leichten Vorteilen für die Messer von Feather.
Die Klingen sollten regelmäßig mit einem Pinsel von Paraffinresten gereinigt werden, damit glatte Schnitte ohne Riefen erhalten werden. Botanische Proben können das Messer recht schnell verschleißen (z.B. durch feinste Sandpartikel auf Wurzelstücken), im Normalfall wird man 20-50 Schnitte machen können, bevor die Klinge gewechselt werden sollte. Am kritischsten ist immer der erste Schnitt eines Schnittbandes. Um ein Einrollen zu vermeiden, ist es hilfreich, den Schnitt knapp an der Schneide der Klinge mit einem kleinen Holzstäbchen niederzudrücken. Wenn der erste Schnitt glatt aufliegt, ergeben alle weiteren Schnitte ein kontinuierliches Band, da die einzelnen Schnitte an der Blockkante aneinanderhaften.
Video 1: Schneiden am Rotationsmikrotom
2.4 Aufziehen der Schnitte
Die Schnittbänder bestehend aus 4-5 Schnitten können mit einer Pinzette oder einem Holzstäbchen aufgenommen und ins Streckbad (siehe Abbildung 2‑2) transferiert werden. Das Streckbad ist mit temperierten (45 °C) destillierten Wasser gefüllt, sodass sich die Schnitte beim Einlegen strecken und glätten. Mit einer gekröpften Pinzette lassen sich die einzelnen Schnitte aus dem Band abtrennen, um sie dann einzeln auf einen Objektträger aufzuziehen. Das überschüssige Wasser lässt man vom Objektträger abtropfen. Danach werden die Objektträger getrocknet, um eine gute Anhaftung der Schnitte auf dem Glas zu gewährleisten. Es hat sich bewährt, die Objektträger bei Raumtemperatur trocknen zu lassen, und sie am nächsten Tag weiter zu verarbeiten.
Die Schnitte sollten relativ kurz (<2 min) im Streckbad liegen, da sich ansonsten beim Trocknen Blasen unter dem Paraffin bilden können, welche die Präparate zerstören. Das destillierte Wasser muss regelmäßig getauscht werden, weil aus dem Paraffin Substanzen herausgelöst werden, die in Kombination mit der erhöhten Wassertemperatur Pilzwachstum im Streckbad nach sich ziehen können.
Video 2: Trennen der Schnitte im Streckbad
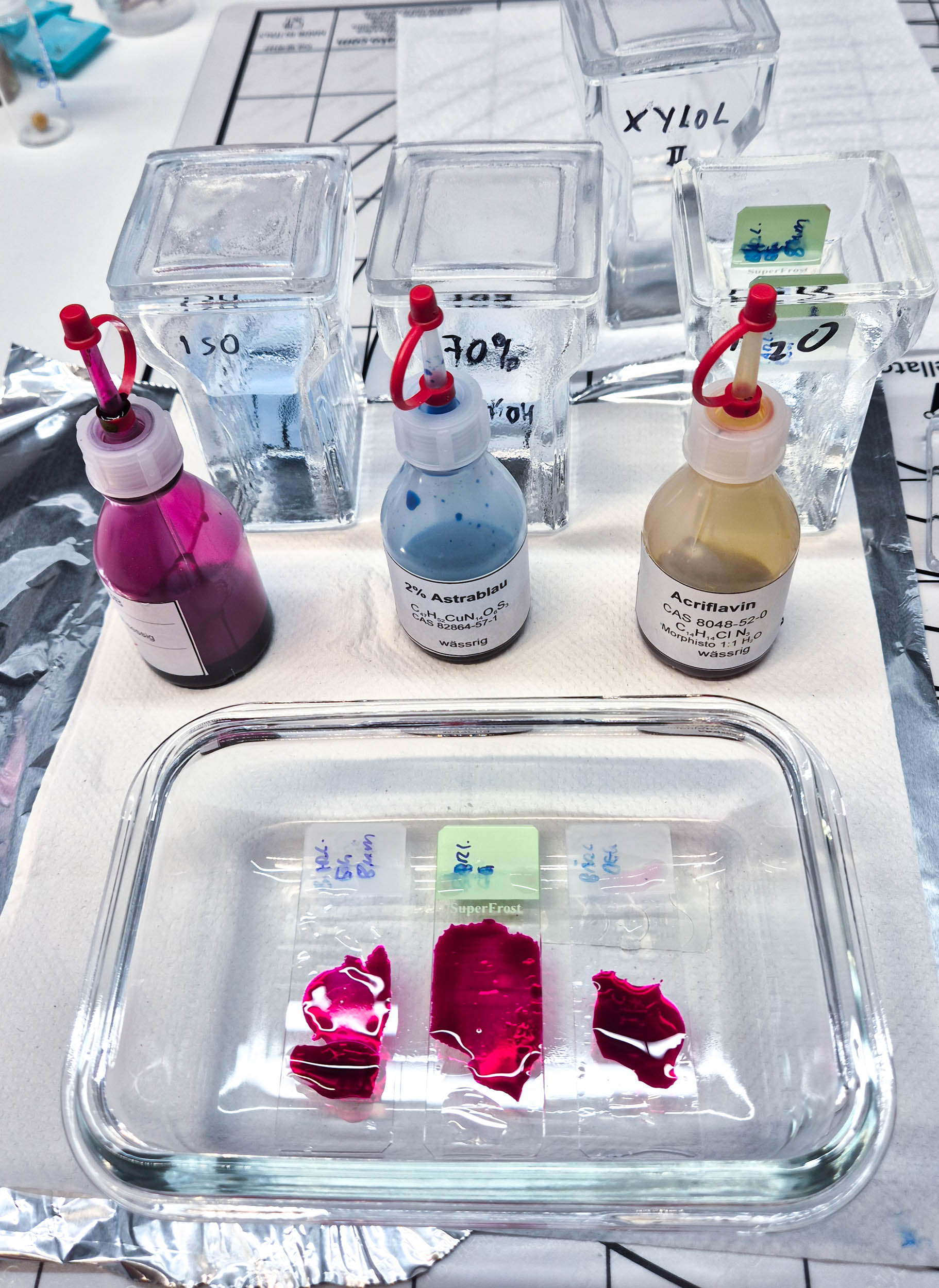
Abbildung 2‑3: Die Objektträger werden in Färbeküvetten entparaffiniert. Die Färbung selbst kann am einfachsten in Glasgefäßen passender Größe erfolgen.
2.5 Entparaffinieren und Färben
Im nächsten Schritt muss das im Schnitt verbliebene Paraffin aufgelöst und entfernt werden. Bevor der Objektträger in das Lösungsmittel getaucht wird, ist es empfehlenswert, ihn auf einem beheizten Strecktisch oder einer Laborheizplatte bei 45 °C für ca. 15 min vollständig zu trocknen. Durch die erhöhte Temperatur wird auch die Anhaftung des eigentlichen Objektes auf dem Glas verbessert.
Der erwärmte Objektträger kann dann in der folgenden Sequenz für die Färbung vorbereitet werden:
- Xylol bei 45°C
- Isopropanol
- Ethanol 70%
- Wasser
Um die Reste vom vorigen Schritt vollständig zu entfernen, ist eine vorsichtige Bewegung im Lösungsmittel hilfreich. Anhand der ablaufenden Schlieren erkennt man meistens recht gut, ob das vorige Lösungsmittel noch an der Oberfläche anhaftet. Um mehrere Objektträger gleichzeitig verarbeiten zu können, sind Färbeküvetten sehr hilfreich, auch wenn dadurch der Verbrauch an Lösungsmittel etwas höher ist.
Für die Färbung selbst ist es am einfachsten, die Objektträger horizontal in einem geeigneten Glasgefäß zu positionieren (siehe Abbildung 2‑3). Auf jeden Objektträger werden dann zwei bis drei Tropfen Färbemittel aufgetropft. Nach ausreichender Einwirkzeit gemäß der jeweiligen Anleitung wird die Färbelösung abgewaschen, und im Anschluss an die Färbung kann das Präparat eingedeckt werden.
3 Mikrofotografie von Paraffinschnitten
Aufgrund der Ästhetik und des Informationsgehaltes vieler botanischer Paraffinschnitte ist es vielfach wünschenswert, die Präparate fotografisch festzuhalten. Idealerweise erhält man so eine Mikrofotografie, die visuell attraktiv ist, aber auch inhaltliche Details ohne Artefakte wiedergibt. Um dieses Ziel zu erreichen, ist es sinnvoll, einige optische Randbedingungen zu kennen und diese bei der Planung der Aufnahme zu berücksichtigen. Um diese Planung zu erleichtern, sind in Tabelle 3-1 für verschiedene Objektive optische Parameter dargestellt. In den meisten Fällen ist eine mehr oder weniger umfangreiche Bildbearbeitung notwendig, um eine optimale Bildqualität zu erreichen. Die dafür erforderlichen Schritte werden hier ebenfalls kurz dargestellt.
3.1 Optische Randbedingungen
Ausgangspunkt der Überlegungen ist es, ein Bild in einem Ausgangsformat wiederzugeben, welches eine relativ hohe Auflösung erfordert (z.B. Ausdrucke im Format DIN A2 oder Wiedergabe auf einem 8K Monitor). Für ein Foto im DIN A2-Format, welches mit einer Auflösung von 300 ppi ausgedruckt werden soll, sind beispielsweise 35 Megapixel (MPx) erforderlich, siehe [4, S. 755]. Um feststellen zu können, ob diese Pixelzahl mit einer einzelnen Mikroskopaufnahme erzielbar ist, muss bekannt sein, welche maximale Anzahl an Bildelementen mit einem gegebenen Objektiv abgebildet werden kann. Dazu kann man folgendermaßen vorgehen:
Die laterale Auflösung d des Objektivs ist gegeben durch
d=0,61 ⋅ λ / NA,
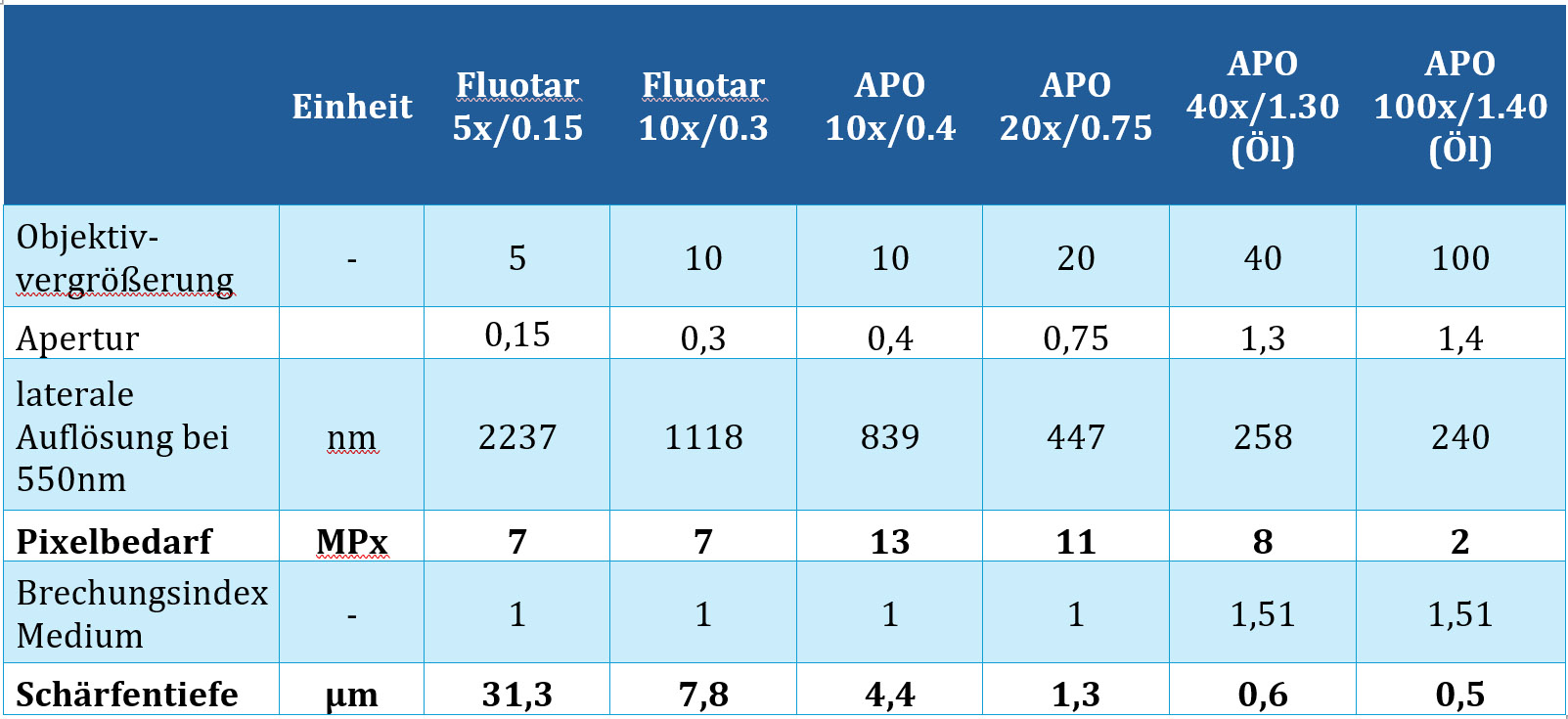
wobei als Lichtwellenlänge λ=550nm gewählt wurde. NA ist die numerische Apertur des Objektivs. Das aufgenommene Bildfeld ist ein Quadrat von 15 mm Seitenlänge, was einem Bildfelddurchmesser von 21,2 mm entspricht. Aufgerundet ist das nahe am Bildfelddurchmesser der heute meistens verwendeten Okulare (22 mm). Entsprechend dem Abtasttheorem müssen in den beiden Raumrichtungen jeweils 2 Pixel zum Abtasten von d zur Verfügung stehen. Angenommen wird weiters, dass ein Sensor mit Bayer-Matrix verwendet wird und alle 4 Pixel (rot, blau, 2mal grün) zum Abtasten des Signals zur Verfügung stehen. Unter diesen Randbedingungen wurden die Werte für die erforderliche Kameraauflösung in Tabelle 3‑1 errechnet. Daraus ist ersichtlich, dass moderne Kameras mit typischerweise >20 MPx in allen Fällen die erforderliche Anzahl an Pixeln bieten. Erkennbar ist, dass hochaperturige Objektive mit geringer und mittlerer Vergrößerung (10x, 20x) die höchsten Anforderungen an die Kamera stellen, während Objektive mit hoher Vergrößerung die geringste Kameraauflösung erfordern.
Andererseits wird auch klar, dass eine einzelne Aufnahme nicht ausreichend ist, um die oben erwähnten größeren Ausdrucke im DIN A2-Format mit ausreichender Auflösung umsetzen zu können. Hier wird es also erforderlich sein, durch Aneinanderreihen mehrerer Aufnahmen zu einem Panorama die notwendige Zahl an Pixeln zur Verfügung zu stellen. Für Aufnahmen botanischer Schnitte wird man vielfach mit 5x- oder 10x-Objektiven arbeiten, und für das oben genannte Beispiel wird dementsprechend ein 3×3- oder 2×3-Panorama erforderlich werden.
Tabelle 3‑1: Um die optisch erzielbare Auflösung eines Objektivs bei einem Bildkreisdurchmesser von 22mm ausnutzen zu können, ist eine Kameraauflösung laut Tabelle erforderlich. Die Schärfentiefe des jeweiligen Objektivs ist ebenfalls angegeben.
Neben der lateralen Auflösung muss natürlich auch die axiale Auflösung und die damit verbundene Schärfentiefe beachtet werden, wenn eine Aufnahme gemacht werden soll, die über die ganze Tiefe des Objektes scharf ist. Da die Schärfentiefe von Objektiven für die Mikroskopie sehr klein ist, können Bildstapel (z-Stacking), erstellt werden, bei denen die einzelnen Bilder an verschiedenen axialen Positionen aufgenommen werden und mit Hilfe einer geeigneten Software die jeweils schärfsten Bildpartien in das finale Bild übernommen werden. Im Endergebnis erhält man so Bilder, in denen Bildelemente über einen großen Tiefenbereich detailreich dargestellt werden.
Sinnvollerweise sollte der z-Abstand zwischen den Einzelaufnahmen nicht viel kleiner sein als die Schärfentiefe des Objektivs. Ansonsten besteht die Gefahr, dass bei einer zu großen Anzahl an Einzelbildern Stacking-Artefakte im endgültigen Bild eingebaut werden. Zusätzlich steigt der Arbeits- und Rechenaufwand unnötig, wenn eine zu große Anzahl an Bildern aufgenommen und verrechnet werden muss.
Die Schärfentiefe Δz gibt an, innerhalb welchen axialen Maximalabstands zwei Objektpunkte scharf dargestellt werden können. Basierend auf folgender Formel aus [5] kann Δz abgeschätzt werden:
Δz= λ⋅1,28⋅n/ NA²,
wobei n der Brechungsindex des Mediums ist. Die entsprechenden Werte für eine Reihe von Objektiven sind in Tabelle 3‑1 dargestellt. Die typische Dicke von botanischen Paraffinschnitten liegt zwischen 5 und 15 µm. Ein z-Stapel ist nur dann sinnvoll, wenn die Schärfentiefe kleiner ist als die Dicke des Schnittes. Aus Tabelle 3‑1 wird klar, dass für Aufnahmen mit 5x- und 10x-Objektiven (mit Ausnahme von hochaperturigen Apo-Objektiven) z-Stapel keine zusätzliche Bildinformation (und damit verbunden Bildschärfe) liefern werden. Bei höheren Vergrößerungen, insbesondere mit 40x- und 100x-Objektiven, ist die Situation eine ganz andere: Hier ist die Schärfentiefe so klein, dass z-Stapel sehr sinnvoll sein können. In Abbildung 4‑5 (a) und Abbildung 4‑7 (d) sind Aufnahmen gezeigt, für die ein z-Stapel aufgrund der hohen Vergrößerung (100x Objektiv) hilfreich ist, um sehr kleine botanische Strukturen besser abbilden zu können. Aus Tabelle 3‑1 lässt sich erkennen, dass die Zahl der Bilder im Stapel nicht sehr groß sein muss. Typischerweise wird man bei mittleren und hohen Vergrößerungen mit fünf bis fünfzehn Aufnahmen das Auslangen finden.
Angemerkt sei hier noch, dass obige Überlegungen nur eine Richtschnur sein können. Es gibt alternative physikalische Modelle zur Betrachtung der Schärfentiefe, siehe [4, S. 153], [6], [7, S. 46]. Weiters können die individuellen Ansprüche an Schärfe und Bildqualität variieren, sodass im Einzelfall eine andere Vorgangsweise als oben beschrieben angebracht sein kann.
3.2 Bildbearbeitung
Basierend auf den obigen Überlegungen soll im Folgenden exemplarisch der Workflow von der Aufnahme bis zum fertigen Bild illustriert werden. Das Präparat war ein Paraffinschnitt einer Fichtenknospe mit 12 µm Schnittdicke. Gefärbt wurde mit Hamburger Grün [8].
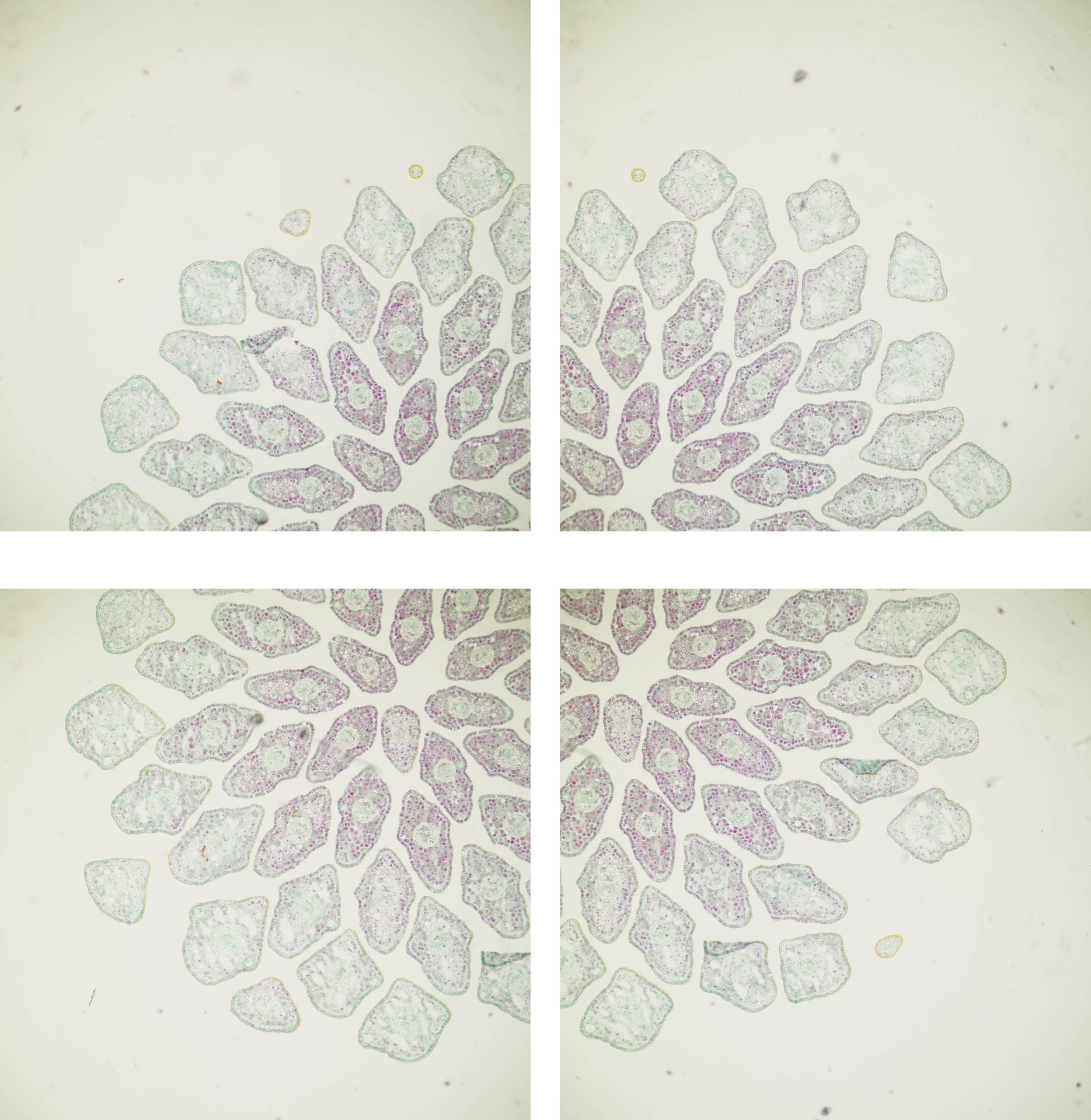
Abbildung 3-1: Einzelaufnahmen für ein 2×2-Panorama. Objekt war ein Fichtentrieb, der als Paraffinschnitt (8µm Schnittdicke) mit Hamburger Grün [8] eingefärbt wurde. Die Einzelaufnahmen sind mit einem 5x-Objektiv (NA 0,15) aufgenommen worden.
Aufgrund der Größe des Objektes war eine Panoramaaufnahme bestehend aus 4 Teilbildern notwendig, die mit einem Leica HC PL Fluotar 5/0.15 und einer Systemkamera (Panasonic G9) aufgenommen wurden. Um später einen reinweißen Hintergrund zu ermöglichen, wurde mit +1,66 Blendenwerten überbelichtet. Abbildung 3-1 zeigt die entsprechenden Einzelaufnahmen. Die weitere Bildbearbeitung wurde mit Adobe Lightroom und Photoshop durchgeführt. Da keine speziellen Features der Software verwendet wurden, sind mit leichten Anpassungen die meisten heute verfügbaren Bildbearbeitungsprogramme in ähnlicher Weise einsetzbar.
In den Einzelbildern wird sichtbar, dass die Kamera beim automatischen Weißabgleich Probleme mit der verwendeten LED Beleuchtung (Leica DM 2000 LED) hatte. Zusätzlich macht sich eine leichte Vignettierung bemerkbar, und einzelne Schmutzpartikel im Paraffinschnitt sind erkennbar. Um diese Bildfehler zu korrigieren, wird als erstes ein Panorama der vier Einzelbilder erstellt (siehe Abbildung 3-2-a). Im nächsten Schritt kann in Lightroom der Weißabgleich angepasst werden (Abbildung 3-2-b) um danach Weißpunkt und Schwarzpunkt geeignet einzustellen. Schließlich wurden Sättigung und Dynamik erhöht sowie die Tiefen herabgesetzt. Das Bild hat jetzt einen einheitlichen hellgrauen Hintergrund, und die Färbung kommt schon recht gut zur Geltung. In dieser Form wurde das Bild in Photoshop weiter bearbeitet. Mit dem Reparaturpinsel wurden die ungewollten Schmutzpartikel entfernt, und mit dem Füllwerkzeug wurde der hellgraue Hintergrund gegen einen reinweißen Hintergrund ausgetauscht. Zusätzlich wurde ein Größenbalken in das Bild eingefügt. Das Ergebnis dieser Bearbeitung ist in Abbildung 4-1-a zu sehen. In diesem Beispiel war für Bildaufnahme und Bildbearbeitung ein Zeitaufwand von ca. 20 min erforderlich.
Abbildung 3-2: (a) zeigt die Aufnahme nach dem Zusammenfügen als Panorama. In (b) wurde der Weißabgleich durchgeführt, und in (c) Weißpunkt, Schwarzpunkt, Sättigung und Dynamik angepasst. Zusätzlich wurden die Tiefen deutlich herabgesetzt.
4 Anwendungsbeispiele
In diesem Abschnitt werden exemplarisch einige Beispiele gezeigt, die illustrieren sollen, wie botanische Paraffinschnitte einerseits sehr ästhetische Aufnahmen des Formenreichtums in der Botanik ermöglichen, und andererseits auch inhaltliche Erkenntnisse durch detaillierte Darstellung sehr kleiner Strukturen erlauben. Ein Teil der Präparate und Aufnahmen wurde beim Treffen der MGW in Kefermarkt (August 2025) erstellt, vielen Dank an Gerhard Zimmert, Sylvia Buchta sowie an Karin und Gerhard Vlcek für die Hilfe und Ratschläge.
4.1 Nadelblätter
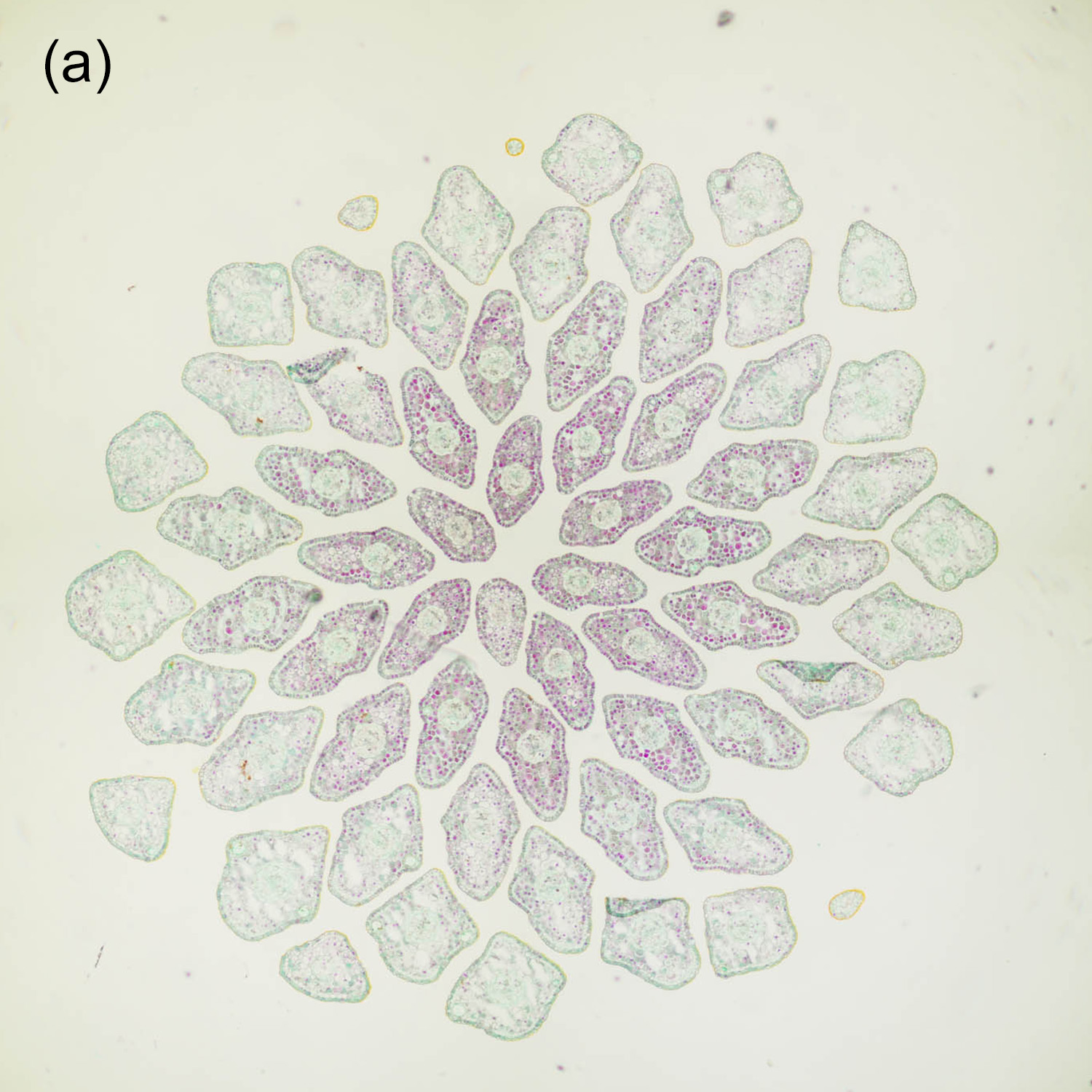
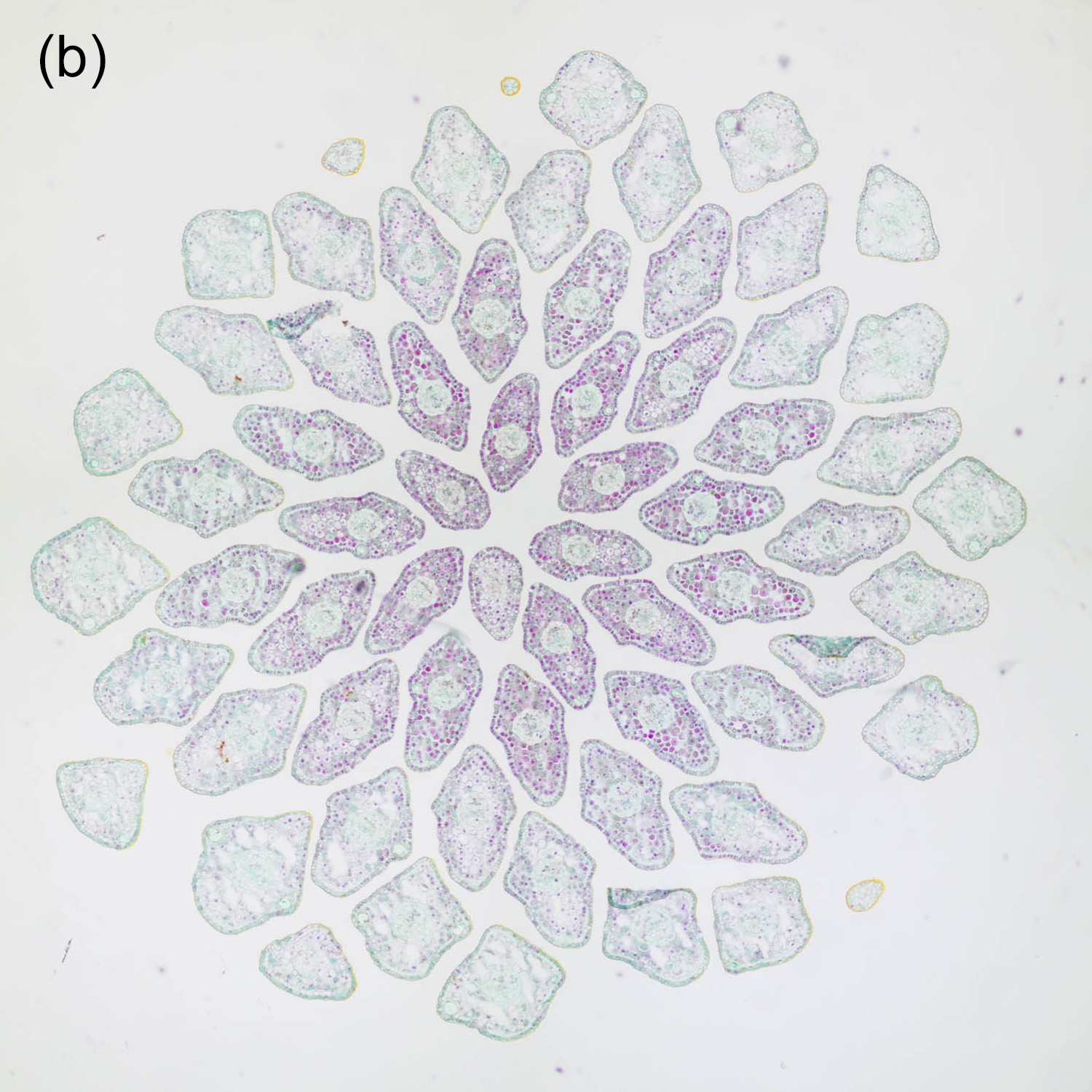
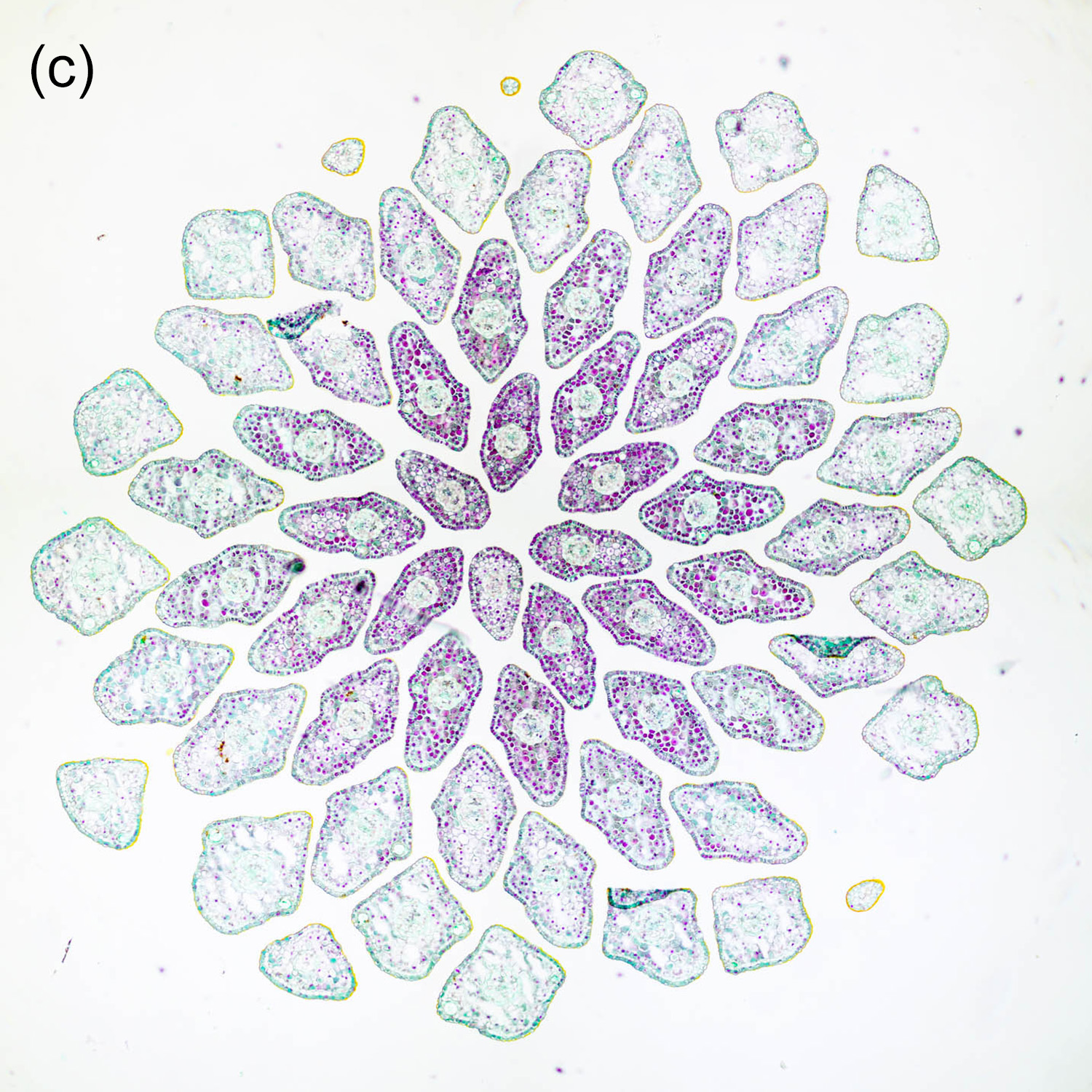
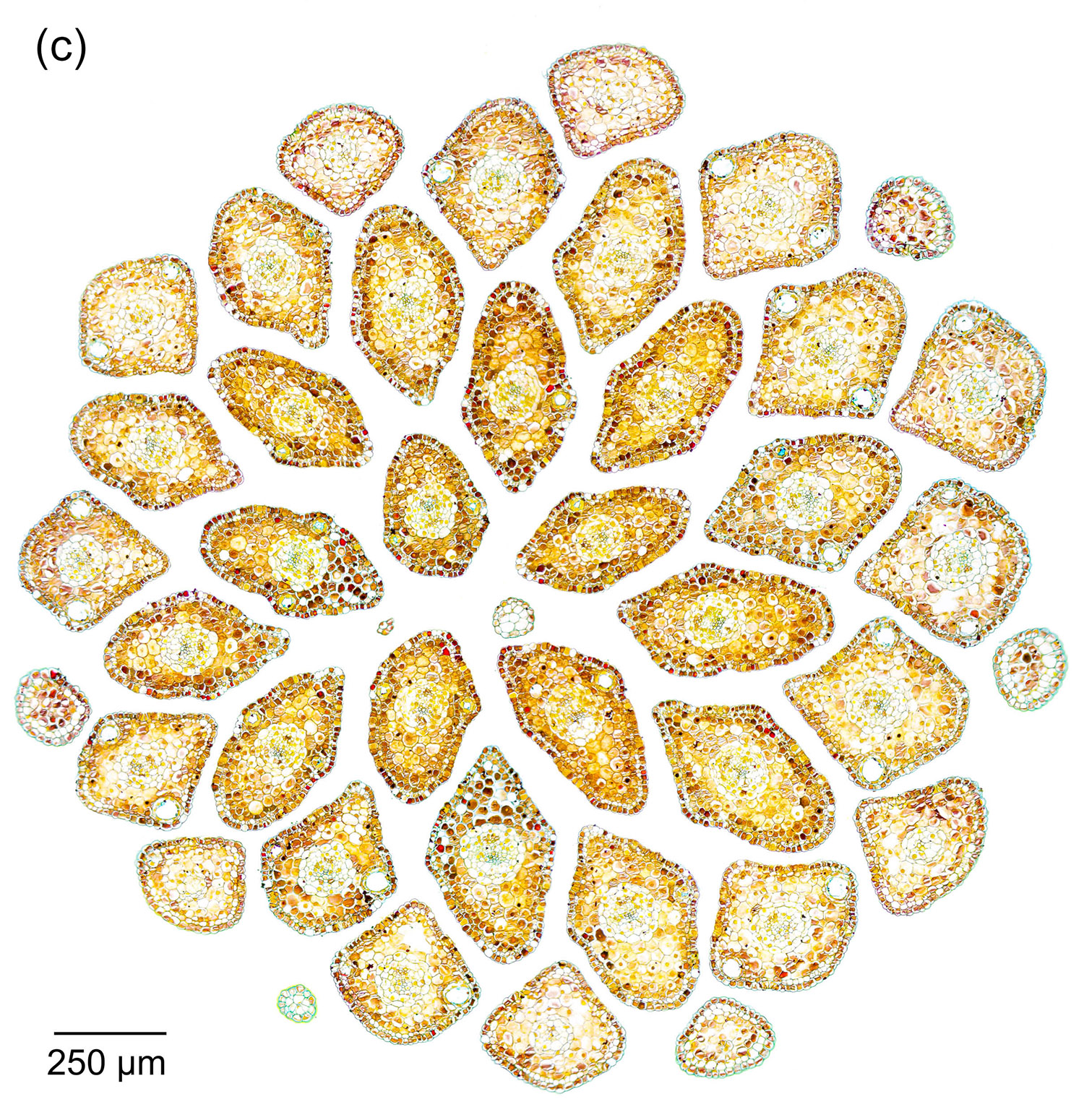
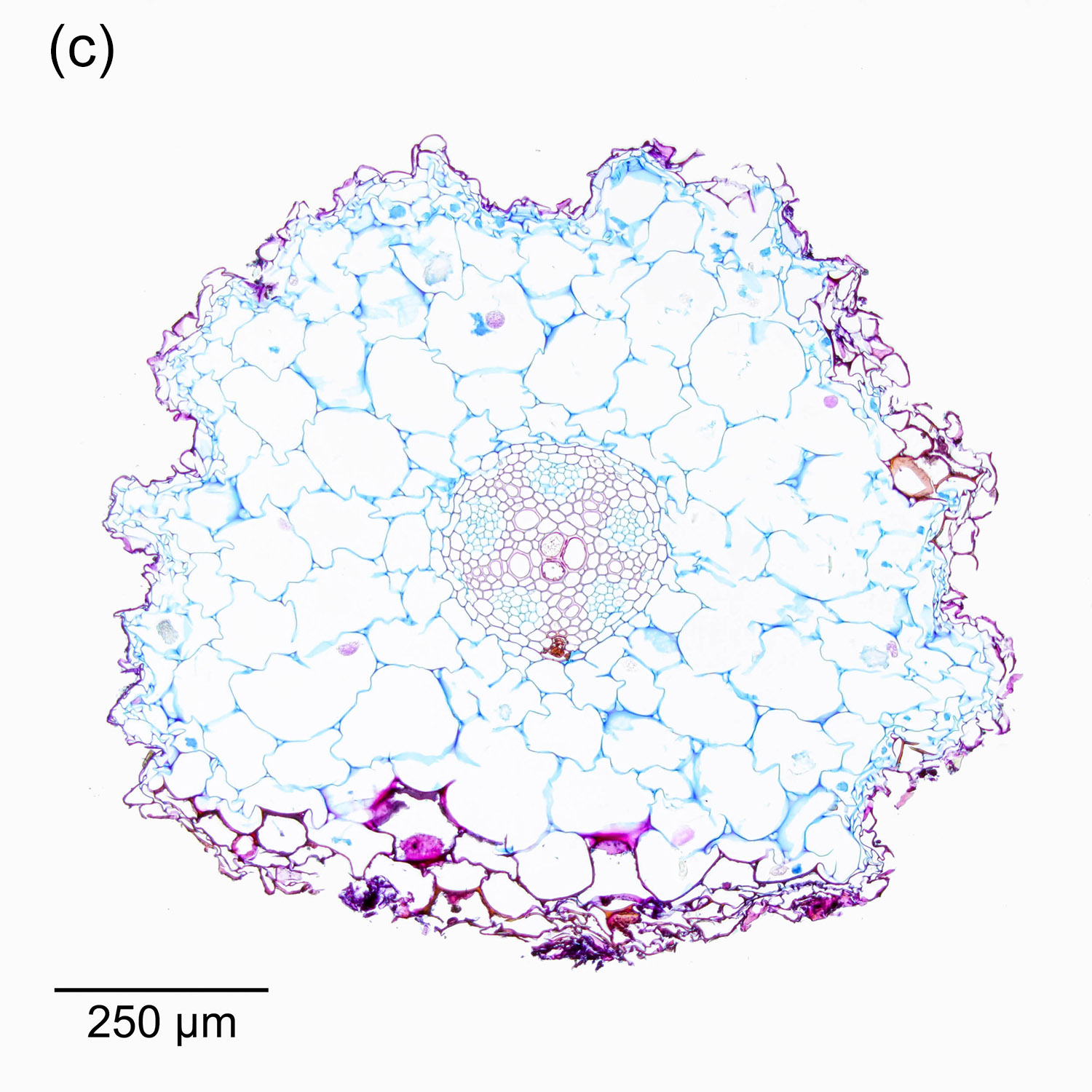
Der Durchmesser von Nadelblättern liegt meistens im Bereich weniger Millimeter, zum Teil sogar deutlich darunter. Daher ist es hilfreich, recht dünne Schnitte herzustellen, um ein sinnvolles Verhältnis zwischen Querschnittsfläche und Dicke zu erhalten. Abbildung 4‑1 und Abbildung 4‑2 zeigen entsprechende Darstellungen der Nadeln in der Triebspitze einer Fichte. Die „kirchenfensterartige“ Anordnung der jungen Nadeln ergibt ein schönes geometrisches Muster. In Kombination mit einer passenden Färbung erhält man so eine interessante mikrofotografische Aufnahme und zusätzlich detaillierte Informationen über den Aufbau der Nadeln.
Abbildung 4‑1: Nadeln der Triebspitze einer Fichte (Picea abies). 8 µm Schnittdicke, Färbung Hamburger Grün (a), Etzold FCA (b) und Wacker Acridinrot-Acriflavin-Astrablau (c, d).
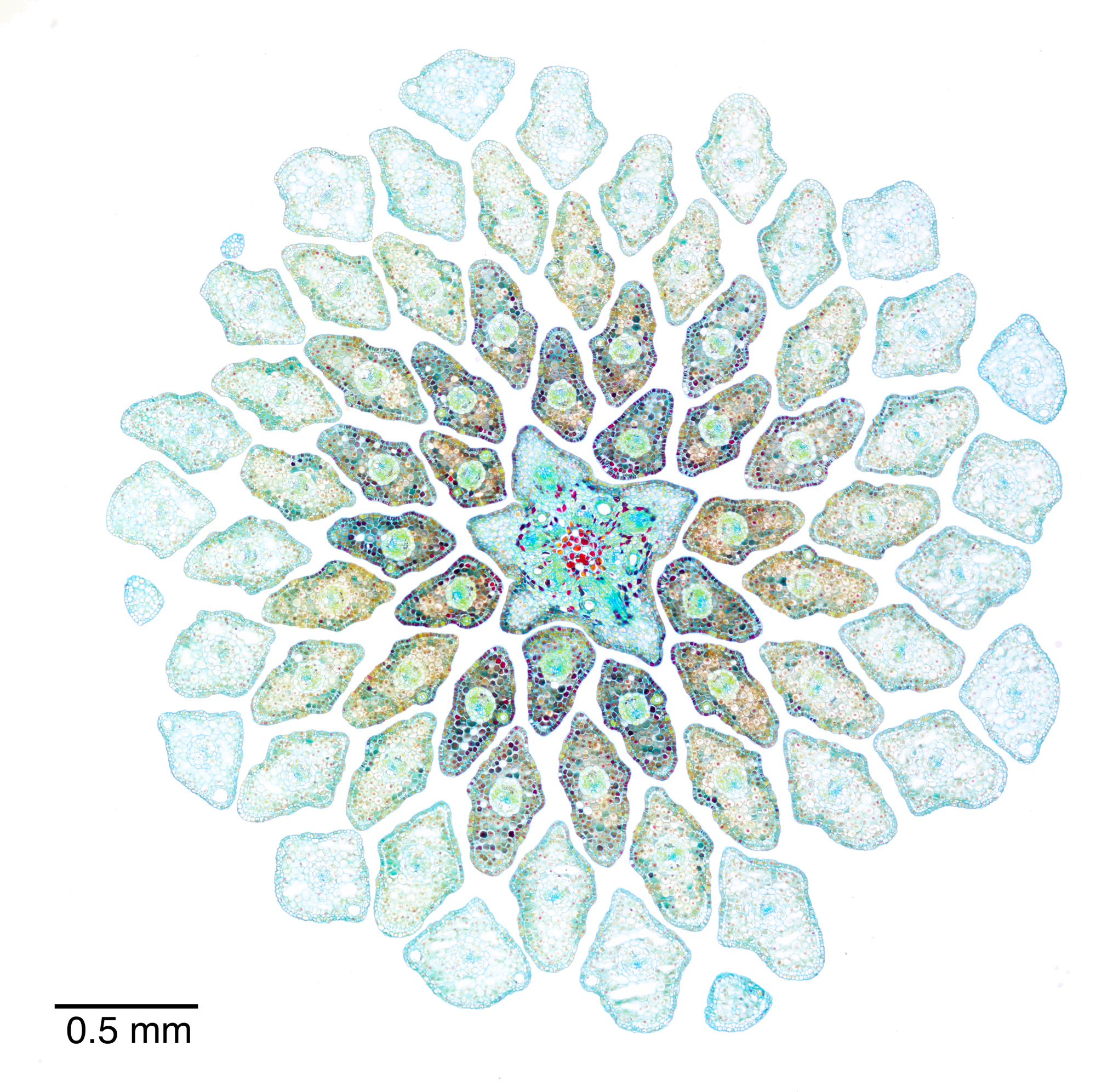
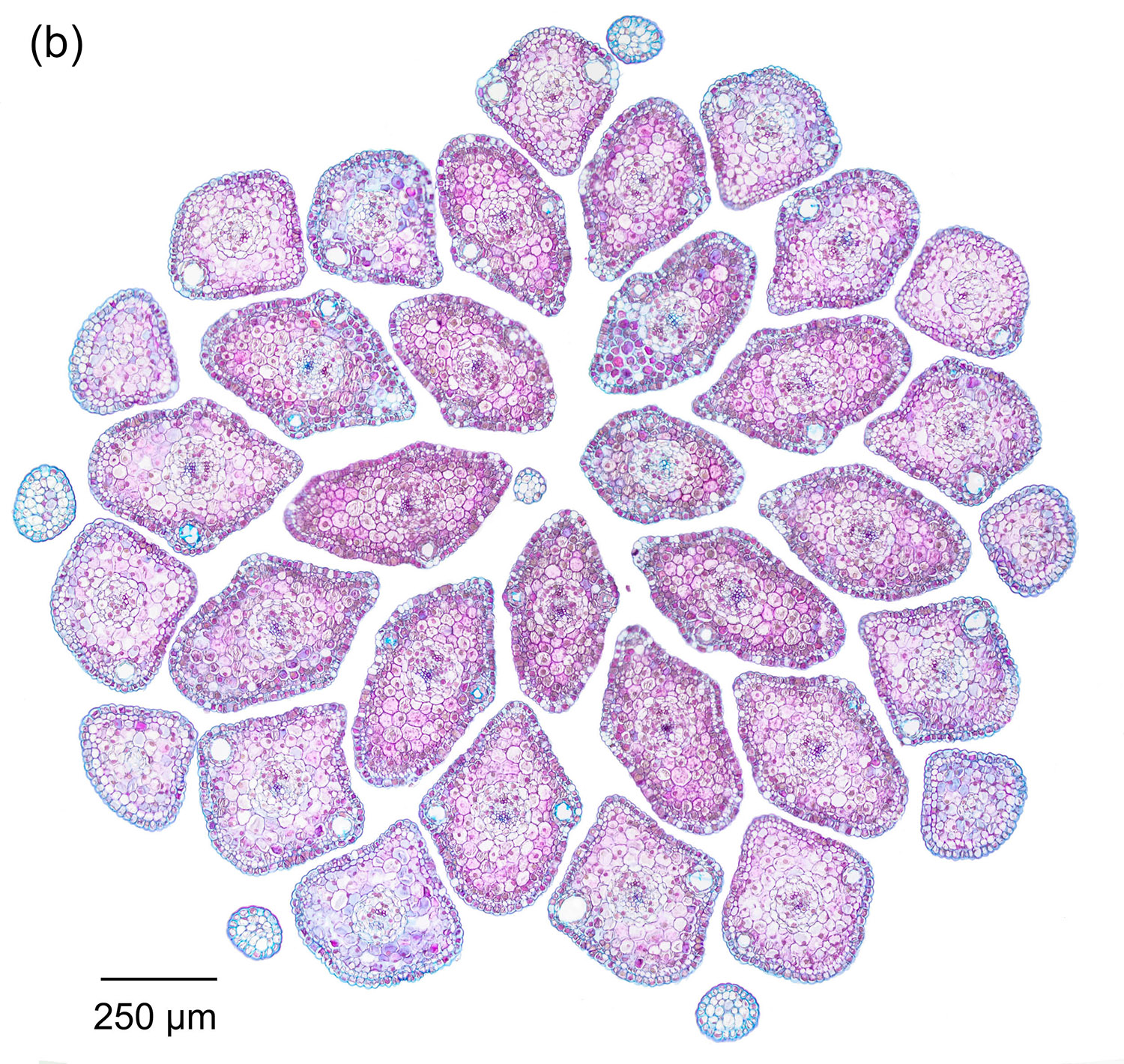
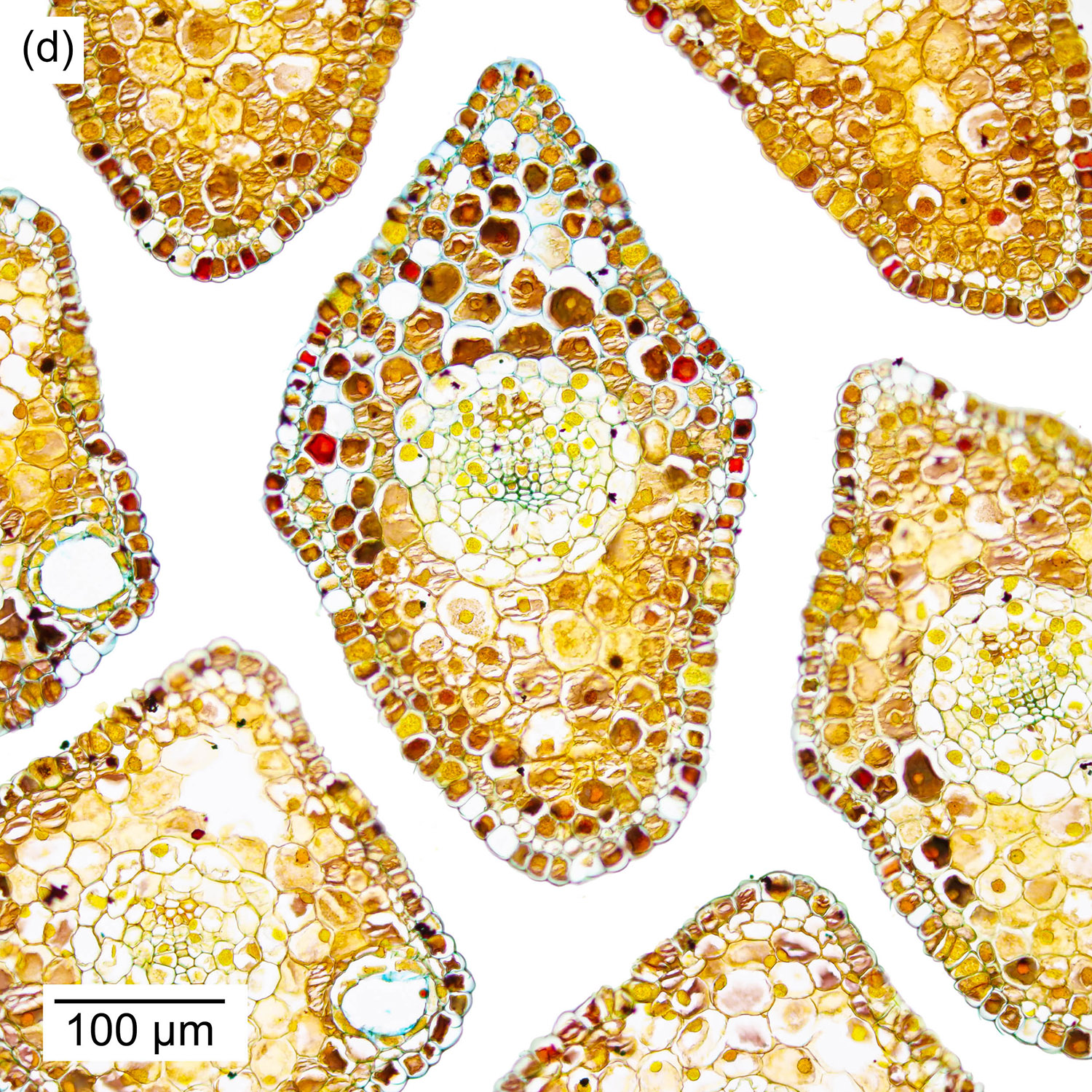
Abbildung 4‑2: Querschnitt durch einen jungen Nadeltrieb der Fichte (Picea abies). 12 µm Schnittdicke, Färbung mit Wacker Acridinrot-Acriflavin-Astrablau. Präparat: S. Buchta. Panorama aus 4 Aufnahmen mit dem 5x-Objektiv.
4.2 Blüten
Blüten sind dankbare Objekte für Paraffinschnitte: Kleine Strukturen (z.B. Pollen) erfordern dünne Schnitte, und die nicht zusammenhängenden Gewebe verhindern Schnitte an Proben, welche nicht eigebettet wurden. Zusätzlich hat der komplexe innere Aufbau der Blüten zur Folge, dass sich beim Betrachten der gefärbten Schnitte sehr interessante geometrische Formen offenbaren.
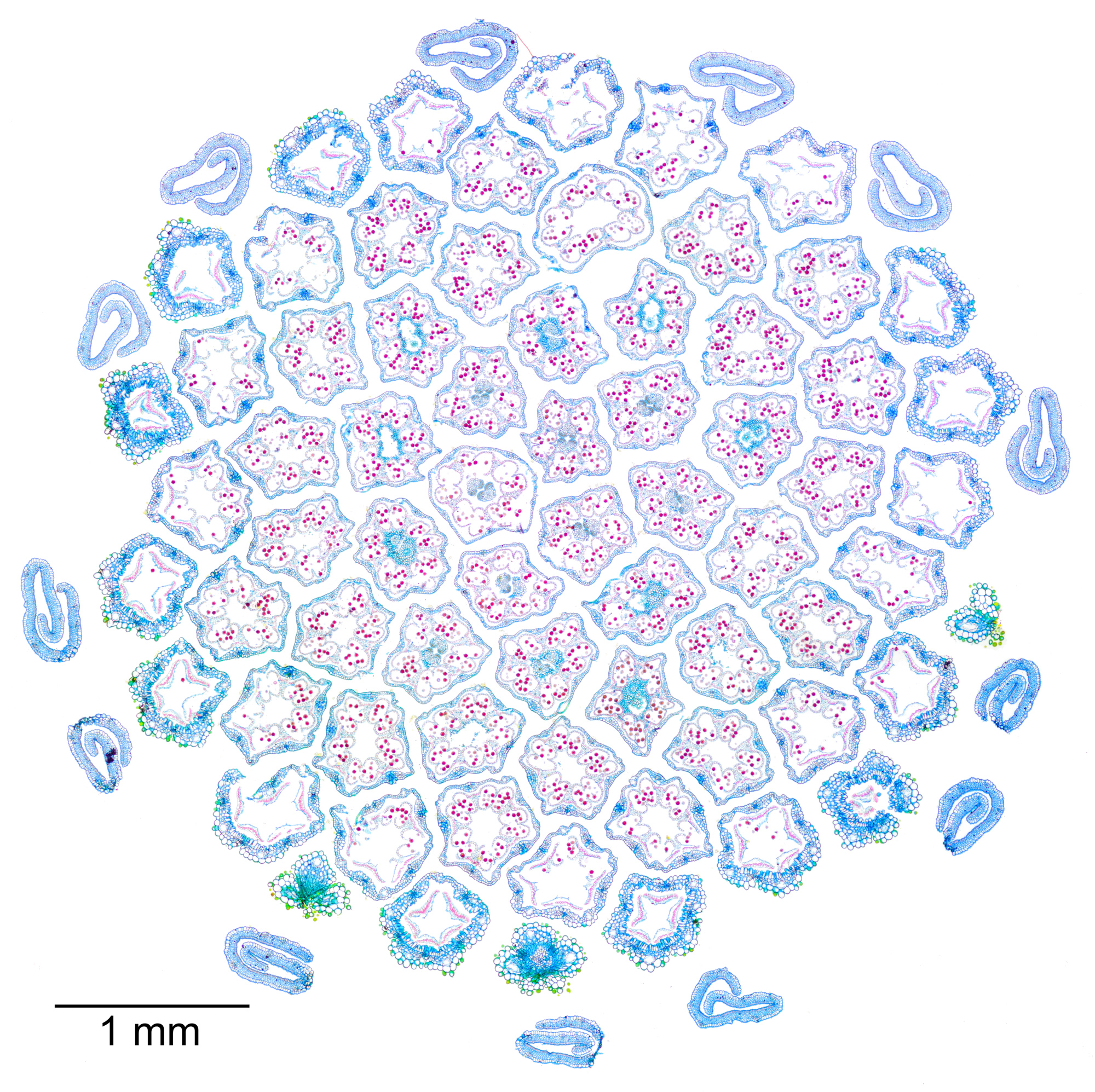
Abbildung 4‑3: Querschnitt der Blüte des schmalblättrigen Greiskrauts (Senecio inaequidens), 10µm Schnittdicke, Färbung Wacker Acridinrot-Acriflavin-Astrablau. Panorama aus 9 Aufnahmen mit einem 5x-Objektiv.

Abbildung 4‑4: Querschnitt der Blüte des Hohen Fingerkrauts (Potentilla recta), Präparat von K. und G. Vlcek. 12 µm Schnittdicke, Färbung mit W3A Einfachfärbung. Panorama aus 4 Aufnahmen, 5x Objektiv.
Korbblütengewächse sind ein besonders attraktives Objekt, da die zahlreichen Röhrenblüten dafür sorgen, dass die finale Aufnahme nicht zu leer wirkt. Mit entsprechend gewählten Färbungen ergeben sich auch interessante Farbmuster. Abbildung 4‑3 zeigt einen Querschnitt durch eine solche Blüte (schmalblättriges Greiskraut). Natürlich bieten auch andere Pflanzenfamilien interessante Möglichkeiten, wie beispielsweise aus Abbildung 4‑4 ersichtlich ist.
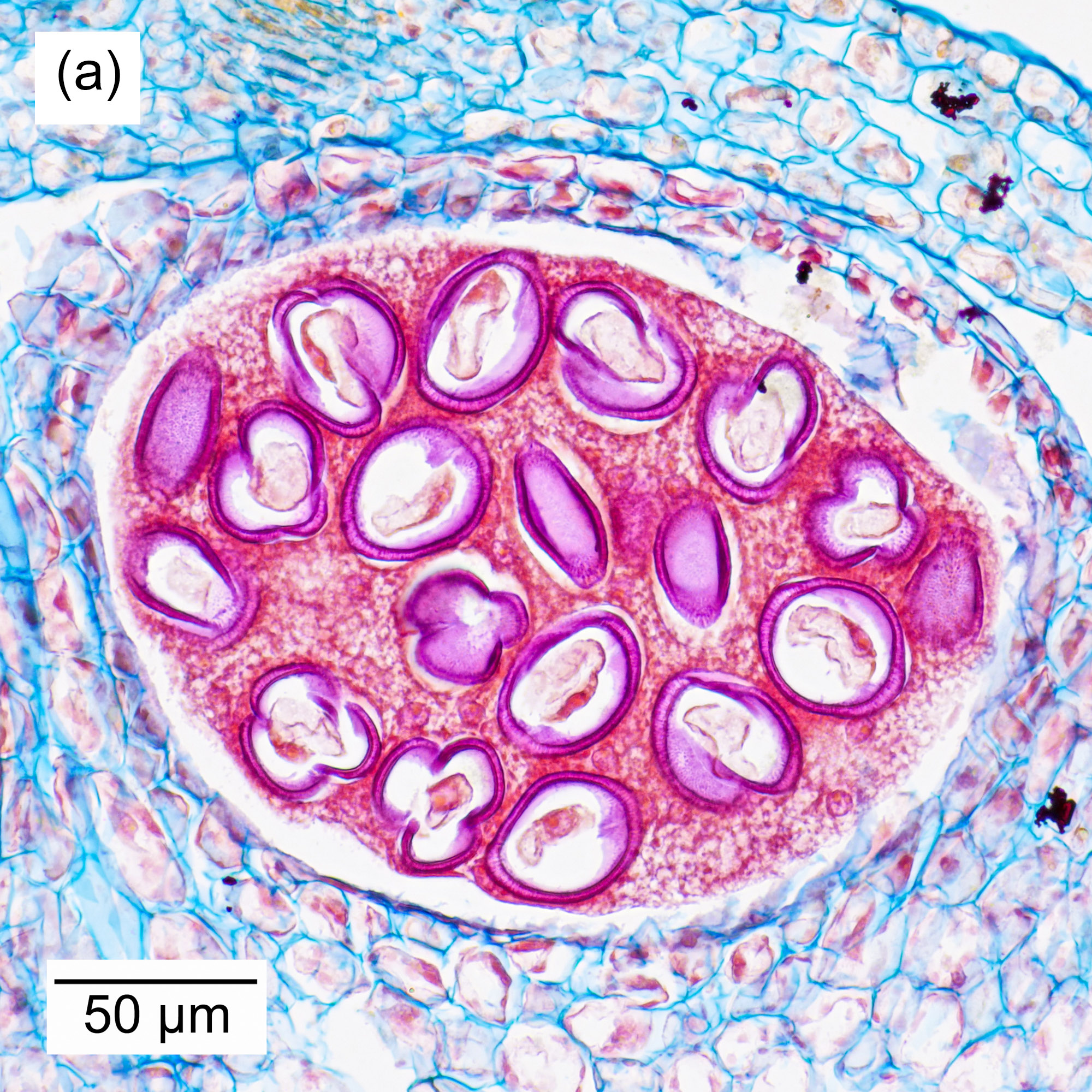
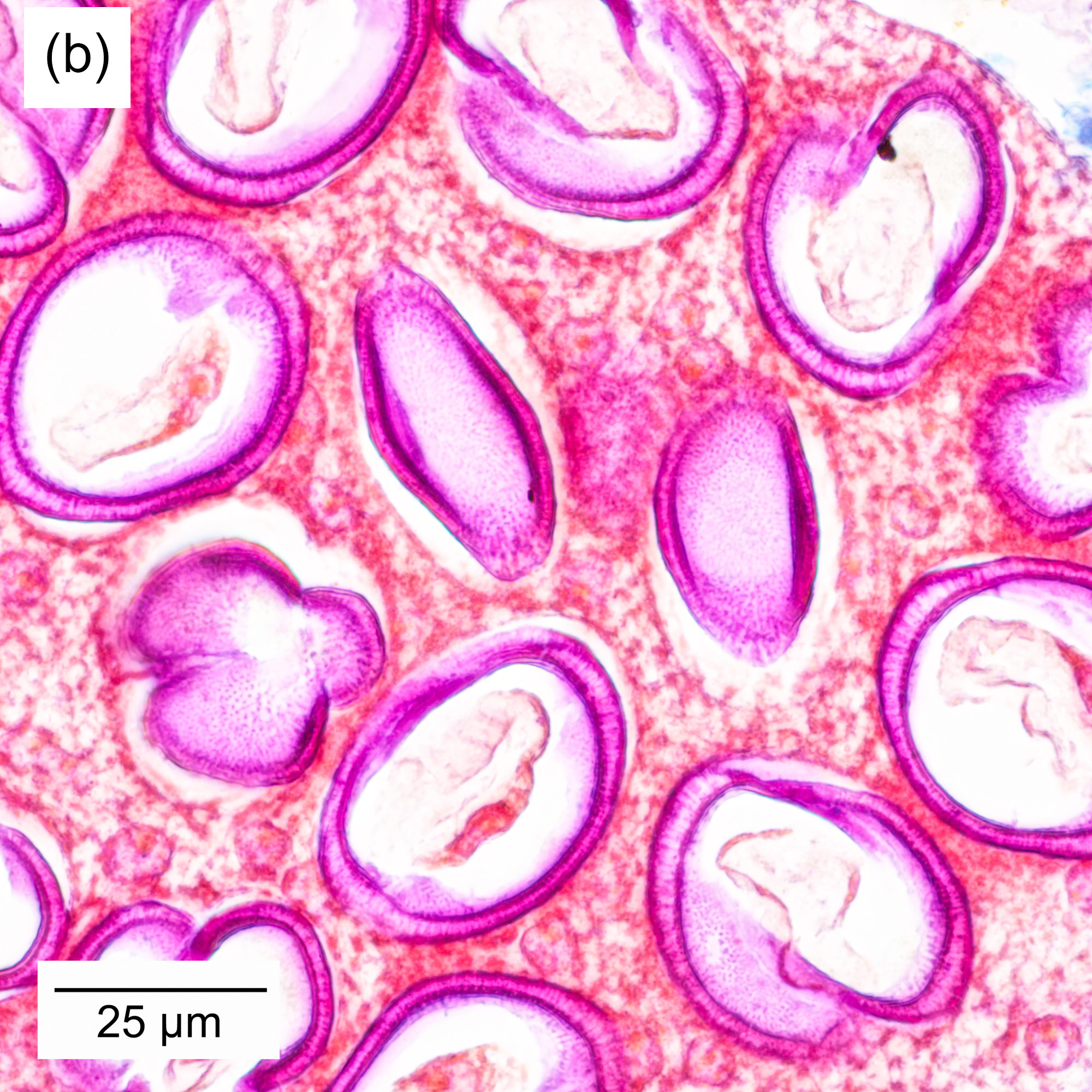
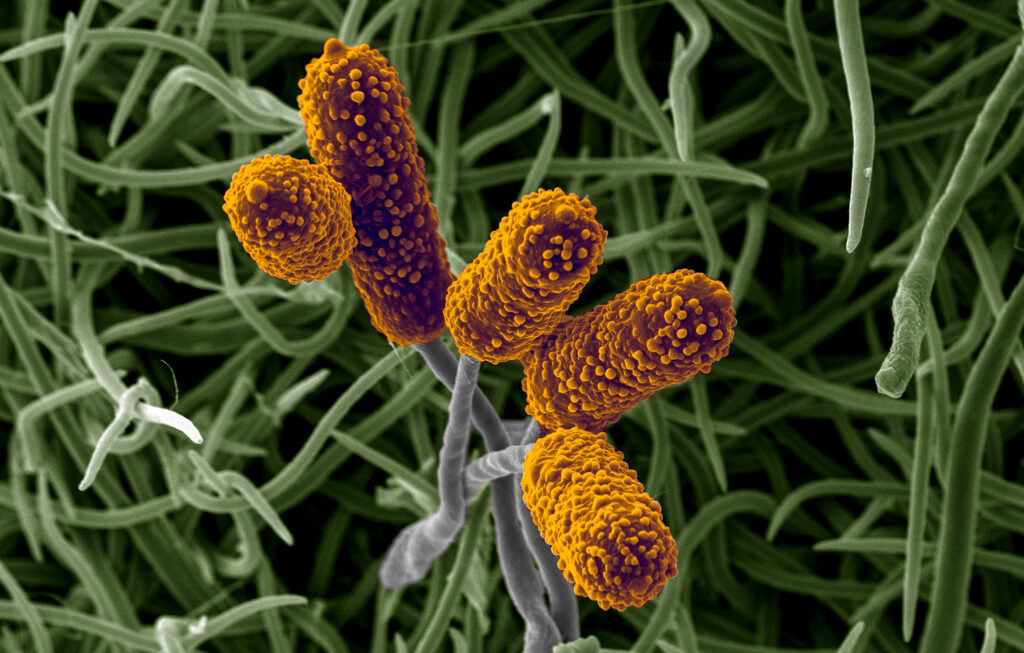
Bei höheren Vergrößerungen werden Details der Blütenpollen erkennbar (Abbildung 4‑5, a und b). Interessant ist hier der Vergleich mit Aufnahmen der Pollen im Rasterelektronenmikroskop (Abbildung 4‑5-c ). Die lichtmikroskopische Aufnahme ermöglicht Einblicke ins Innere der Pollen, während das REM eine sehr kontrastreiche Aufnahme der Oberflächentopographie erlaubt.
Abbildung 4‑5: Detailaufnahme der Blüte einer roten Spornblume (Centranthus ruber), (a), (b) Färbung Wacker Acridinrot-Acriflavin-Astrablau. (c) Aufnahme eines Pollenkorns am Rasterelektronenmikroskop.
4.3 Mykorrhiza
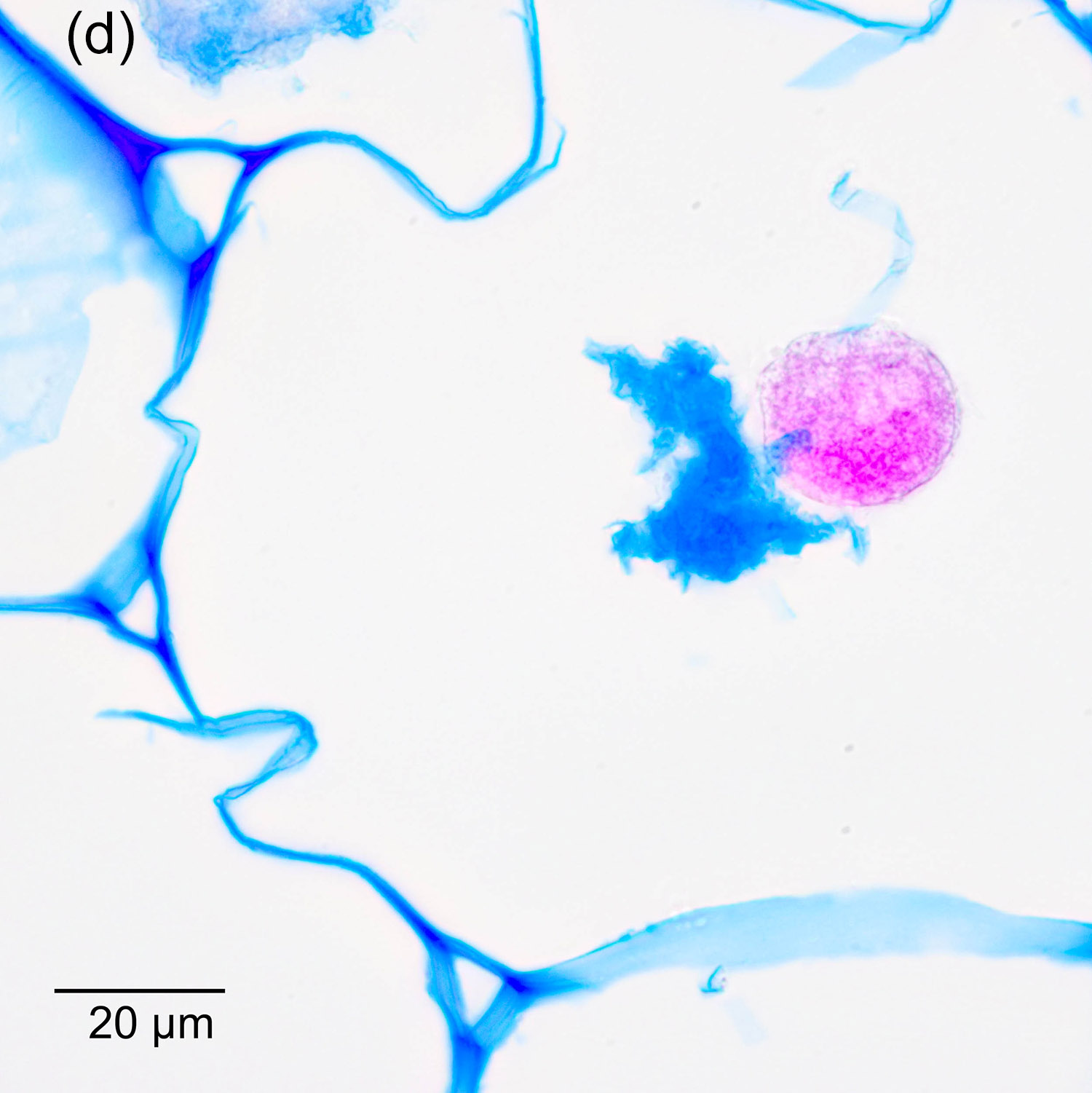
Da die Sporen und die Hyphen der meisten Pilze sehr kleine Durchmesser haben (typischerweise <10µm) und die lockeren Gewebe ohne Einbettung nicht gut geschnitten werden können, ist das Arbeiten mit Paraffinschnitte ein hilfreicher Ansatz. Abbildung 4‑6 und Abbildung 4‑7 zeigen Schnitte (Dicke 7µm) durch die Wurzel eines roten Waldvögleins (Cephalanthera rubra). Erkennbar sind Sporen und Hyphen in Abbildung 4‑6. In Abbildung 4‑7 wird sichtbar, wie sich Pilzhyphen an die Stärkekörner im Inneren der Wurzel anlegen. Interessant ist hier der Vergleich zwischen lichtmikroskopischer Abbildung und der Aufnahme am Rasterelektronenmikroskop.
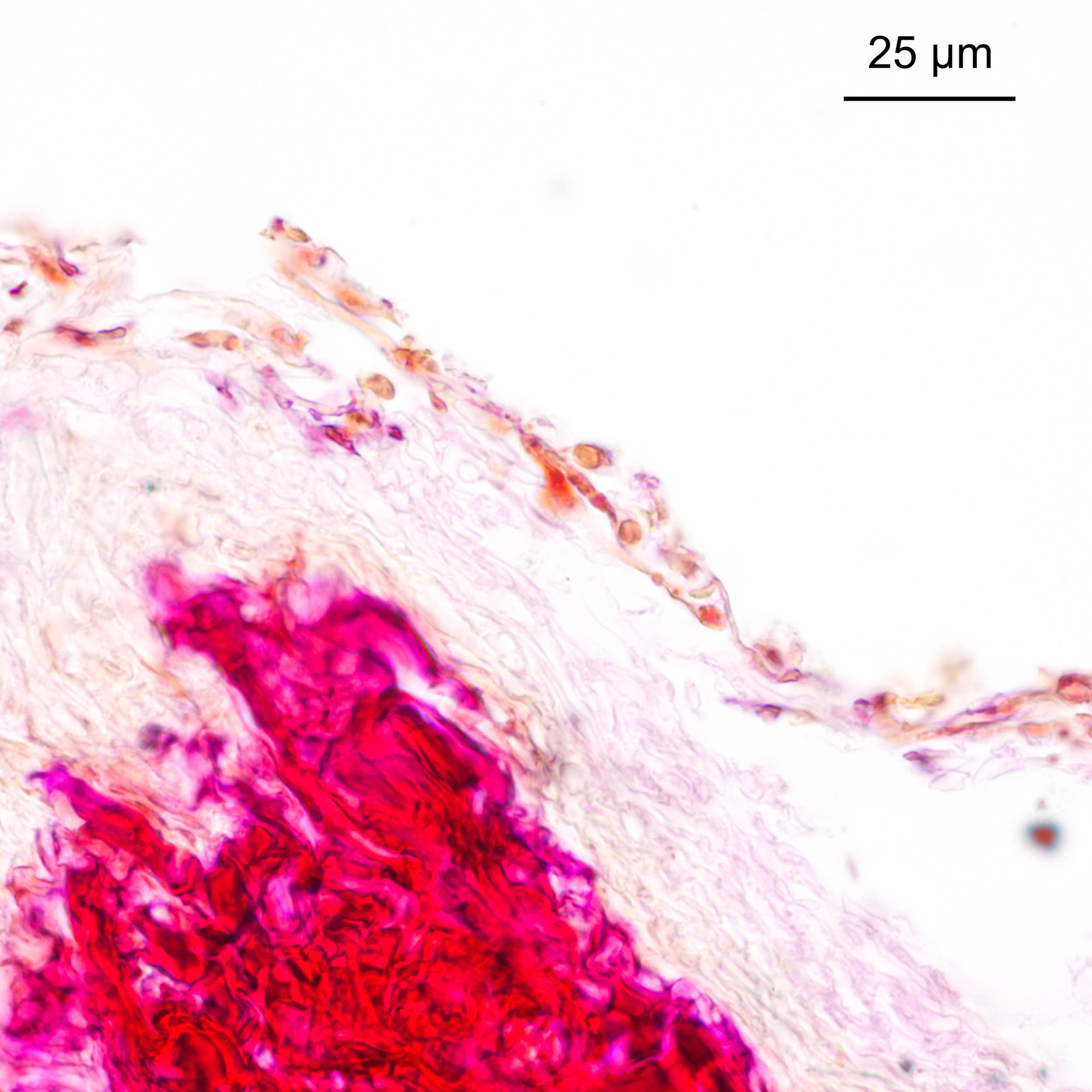
Abbildung 4‑6: Querschnitt durch die Wurzel eines roten Waldvögleins, welche von einem dichten Netz aus Hyphen umgeben ist. An der Oberseite sind einzelne Sporen erkennbar. Färbung: Acridinrot-Acriflavin-Astrablau.
Abbildung 4‑7: REM-Aufnahmen (a, b) der Wurzel eines roten Waldvögleins (Cephalanthera rubra). (a) zeigt den Querschnitt und die Seitenansicht der Wurzel, (b) Hyphen an den Stärkekörnern innerhalb der Wurzel. (c) und (d) zeigen lichtmikroskopische Aufnahmen der Wurzelquerschnitte (Schnittdicke 7µm). (d) ist ein z-Stapel aus 6 Aufnahmen, aufgenommen mit einem 100x-Objektiv.
5 Literatur
[1] S. Buchta und G. Zimmert, „Schneiden und Färben von Präparaten – Mikroskopische Gesellschaft Wien“. Zugegriffen: 10. August 2025. [Online]. Verfügbar unter: https://www.mgw.or.at/schneiden_und_faerben_von_praeparaten/
[2] P. Labrot, „Visite illustrée d’un petit laboratoire amateur de microscopie“. Zugegriffen: 20. August 2025. [Online]. Verfügbar unter: https://www.nirgal.net/microscopie/sub_laboratoire.html
[3] M. Mulisch und U. Welsch, Hrsg., Romeis – Mikroskopische Technik. Berlin, Heidelberg: Springer, 2015. doi: 10.1007/978-3-642-55190-1.
[4] J. Sanderson, Understanding Light Microscopy. Wiley, 2019.
[5] R. Wartmann, „Depth of focus for digital microscopy“, DGaO – Deutsche Gesellschaft für angewandte Optik, Mai 2013, S. B26. Zugegriffen: 18. September 2025. [Online]. Verfügbar unter: https://www.dgao-proceedings.de/archiv/114_chronologisch_d.php
[6] „Berechnung der Schärfentiefe von Mikroskopobjektiven“, Mikro-Forum. Zugegriffen: 18. September 2025. [Online]. Verfügbar unter: https://www.mikroskopie-forum.de/index.php?topic=43795.0
[7] U. Kubitscheck, Fluorescence Microscopy: From Principles to Biological Applications. Weinheim: Wiley-Blackwell, 2017.
[8] J. Weiß, „Rund um das Hamburger Grün“. Zugegriffen: 23. August 2025. [Online]. Verfügbar unter: https://mikroskopie-bonn.de/bibliothek/botanische_mikrotechnik/388.html